มะเร็งตับอ่อน
มะเร็งตับอ่อน
ชวลิต เลิศบุษยานุกูล พบ.
มะเร็งตับอ่อนพบในโรงพยาบาลจุฬาลงกรณ์ ในปี พ.ศ. 2543-2544 ประมาณปีละ 10-17 ราย(1) ผู้ป่วยมะเร็งตับอ่อน มักมาพบแพทย์เมื่อมีก้อนมะเร็งขนาดใหญ่ เนื่องจากอาการในระยะแรกมักไม่จำเพาะ เช่น ปวดท้อง ประกอบกับแพทย์ผู้ดูแลเบื้องต้นอาจไม่ได้ส่งเอกซเรย์ หรือเอกซเรย์คอมพิวเตอร์ บางกรณีผู้ป่วยอาจไม่มีอาการเลย จนกระทั่งเป็นมากแล้ว จึงจะแสดงอาการ อาทิ ปวดท้อง เบื่ออาหาร น้ำหนักลด ตัวเหลือง ตาเหลือง
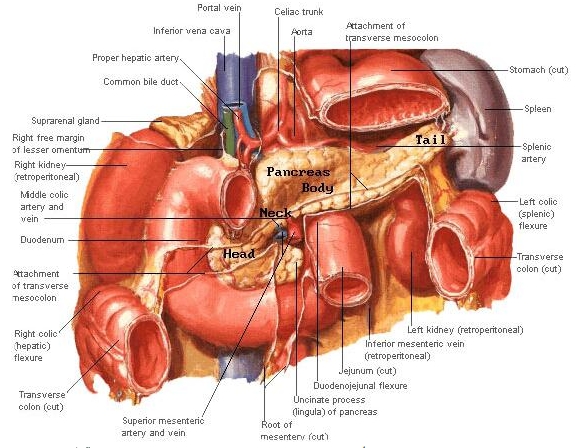
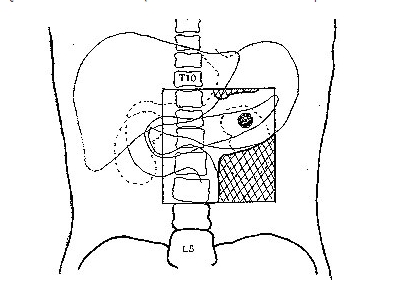
อาการปวดท้องมีลักษณะเหมือนถูกมีดแทงบริเวณลิ้นปี่และปวดร้าวไปข้างหลังผู้ป่วยเพียง 5-22% เท่านั้นที่ก้อนมะเร็งอยู่ในระยะที่ผ่าตัดได้(2,3,4) การรักษาหลักของมะเร็งตับอ่อน ส่วนหัวคือ การผ่าตัดแบบ Whipple ซึ่งพบอัตราการรอดชีวิตที่ 5 ปี (5-year survival rate) ประมาณ 4-24%(5,6) และมัธยฐานเวลาการรอดชีวิต (median survival rate) ประมาณ 15-19 เดือน(7) อัตราการกำเริบเฉพาะที่ (local recurrent rate) และการแพร่กระจาย (distant metastasis rate) สูง ผู้ป่วย 80-85% อยู่ในระยะที่ ไม่สามารถผ่าตัดก้อนมะเร็งออกได้การทำการผ่าตัดเพื่อระบายน้ำดีสามารถช่วยประคับประคองผู้ป่วยและลดอาการของภาวะตับวาย การทำ celiac block สามารถป้องกันอาการปวดซึ่งอาจจะเกิดได้ ในอนาคตผู้ป่วยกลุ่มนี้มักจะเสีย ชีวิตใน 1 ปี และหากไม่ได้รับการรักษาจะมีมัธยฐานเวลาการรอดชีวิตเพียง 3-6 เดือนกายวิภาคตับอ่อนเป็นอวัยวะซึ่งอยู่หลังเยื่อบุช่องท้อง ( retroperitoneum ) ในระดับเดียวกับกระดูกสันหลัง L1-L2 และถูกห้อมล้อมด้วยอวัยวะต่าๆ ซึ่งไวต่อรังสี ได้แก่ กระเพาะอาหาร ตับ ไต ม้าม และลำไส้เล็ก ตามรูปที่ 1
ตับอ่อนประกอบด้วย 4 ส่วน คือ ส่วนหัว, ส่วนคอ, ส่วนลำตัวและส่วนหาง โดยส่วนหางจะชี้ไปทางขั้วม้าม ในขณะที่ส่วนหัวอยู่บริเวณหน้าและด้านข้างของ superior mesenteric artery และมี uncinate process โอบไปทางด้านหลังของเส้นเลือดเส้นนี้ ด้านหน้าของตับอ่อนถูกปกคลุมด้วยเยื่อบุช่องท้อง แต่ด้านหลังของ ตับอ่อนอยู่ติดกับ preaortic soft tissue, superior mesenteric artery และ splenic vein ก้อนมะเร็งที่โตขึ้น จึงมักจะขยายไปทางด้านหลัง และลุกลามไปยังเส้นเลือดดังกล่าว ตลอดจน portal vein และ celiac artery ซึ่งการลุกลามไปยังเส้นเลือดนี้เอง ซึ่งเป็นตัวบ่งชี้สำหรับศัลยแพทย์ว่าจะสามารถผ่าตัดได้หรือไม่ (resectability)ทางเดินน้ำเหลืองของตับอ่อนผ่านทางต่อมน้ำเหลือง pancreaticoduodenal, suprapancreatic, pyloric และ pancreatiocosplenic ซึ่งทั้งหมดนี้จะนำไปสู่ต่อมน้ำเหลือง celiac และ superior mesenteric สำหรับต่อมน้ำเหลืองบริเวณ porta hepatis มักพบในรายที่เป็นมะเร็งระยะเป็นมากเฉพาะที่ ( locally advanced disease )ก้อนมะเร็งที่ส่วนหัวของตับอ่อน สามารถกดทางเดินน้ำดี ( common bile duct ) และ pancreatic duct หรือลุกลามบริเวณรูเปิด Ampulla of vater ซึ่งทำให้เกิดอาการตัวเหลือง ตาเหลือง หรือเกิด exocrine pancreatic insufficiency ได้ รูปที่ 1 แสดงกายวิภาคของมะเร็งตับอ่อนและอวัยวะข้างเคียง
เส้นประสาทที่เลี้ยงบริเวณตับอ่อน ได้แก่ vagus และ splanchnic nerve ซึ่งออกมาจาก celiac และ superior mesenteric plexus หากก้อนมะเร็งลุกลามมาบริเวณปมประสาทนี้สามารถทำให้เกิดอาการปวดแบบ sharp pain ซึ่งร้าวไปที่หลังได้
สาเหตุของมะเร็งตับอ่อน
สาเหตุของมะเร็งตับอ่อนยังไม่ชัดเจน มีรายงานความเสี่ยงต่อการเป็นมะเร็งตับอ่อนพบว่าคนสูบบุหรี่มีความเสี่ยง (relative risk) มากกว่าคนไม่สูบบุหรี่ ประมาณ 1.6-3.1 เท่า(8,9) อาหารที่มีไขมันสัตว์ในปริมาณที่สูง (10,11) การสัมผัสสาร DDT(12) หรืออนุพันธ์ของ ปิโตรเลียม(13) ล้วนมีโอกาสเสี่ยงมากขึ้นสำหรับรังสี(14) หรือยาเคมีบำบัด(15) อาจเพิ่มความเสี่ยงเพียงเล็กน้อยเท่านั้นเบาหวาน, ตับอ่อนอักเสบเรื้อรัง หรือความผิดปกติทางพันธุกรรม อาจมีความสัมพันธ์กับการเกิดมะเร็งตับอ่อนเพียงเล็กน้อย(16-19)
การวินิจฉัย
การประเมินผู้ป่วยและลักษณะก้อนมะเร็งมีเป้าหมายเพื่อให้ทราบว่าจะสามารถผ่าตัดก้อนมะเร็งได้หรือไม่ นอกจากนี้การพิสูจน์ผล ชิ้นเนื้อและการประเมินภาวะทางเดินน้ำดีอุดตันยังเป็นสิ่งจำเป็นในการวางแผนการรักษาการใช้เทคโนโลยี ทาง Imaging ได้แก่การทำ CT Scan โดยเฉพาะอย่างยิ่งการทำ helical CT และการฉีดสารทึบรังสีสามารถตรวจพบก้อนมะเร็งซึ่งมีขนาดเล็ก ๆ ได้และยังสามารถ บอกว่าก้อนมะเร็งติดหรือลุกลามเข้าไปในหลอดเลือดหรือไม่ การใช้ CT-guided fine-needle aspiration (FNA) สามารถช่วยในการพิสูจน์เซลล์มะเร็งได้ แต่วิธีการนี้ต้องอาศัยความชำนาญ ของแพทย์ทางรังสีร่วมรักษา (interventional radiologist)
การพิสูจน์ชิ้นเนื้อที่มีประสิทธิภาพคือการตัดชิ้นเนื้อผ่าน endoscope (ERCP-endoscopic retrograde cholangiopancreaticography) วิธีนี้ยังสามารถช่วยให้ได้ภาพทางรังสี ซึ่งแสดงถึงการอุดตันของท่อน้ำดี และท่อตับอ่อน และช่วยใน การรักษาแบบประคับประคองโดยการใส่ endobiliary stent เพื่อลดอาการดีซ่าน ปัจจุบันมีการใช้ endoscopic ultrasound และการใช้ endoscopic ultrasound-directed FNA เพื่อทำให้การวินิจฉัยแม่นยำขึ้น MRI มีบทบาทในมะเร็งตับอ่อนน้อยกว่า CT scan แต่มีข้อได้เปรียบคือ สามารถทำ MR cholangiography เพื่อช่วยในการดู ทางเดินน้ำดีได้โดยไม่ต้องทำ ERCP แต่ข้อเสียคือใช้เวลาในการทำ (image acquisition) ค่อนข้างนาน หาก Imaging ไม่สามารถบอกได้ชัดเจนว่าก้อนมะเร็งอยู่ในระยะผ่าตัดได้หรือไม่ การทำ laparoscope หรือทำ laparotomy เลยเป็นสิ่งที่ช่วยดูก้อนมะเร็งได้ดีที่สุด
การจำแนกทางพยาธิวิทยา (Pathological classification)
ลักษณะทางพยาธิวิทยาสามารถจำแนกมะเร็งตับอ่อนได้ดังนี้
1. Malignant
1.1 Duct cell carcinoma พบประมาณ 90% ของผู้ป่วยทั้งหมด
1.2 Acinar cell carcinoma
1.3 Papillary mucinous carcinoma
1.4 Signet ring carcinoma
1.5 Adenosquamous carcinoma
1.6 Undifferentiated carcinoma
1.7 Mucinous carcinoma
1.8 Giant cell carcinoma
1.9 Mixed type (ductal-endocrine or acinar-endoerine)
1.10 Small cell carcinoma
1.11Cystadenocarcinoma (serous and mucinous types)
1.12 Unclassified
1.13 Pancreatoblastoma
1.14 Papillary-cystic neoplasm
2. Borderline malignancies
2.1Mucinous cystic tumor with dysplasia
2.2 Intraductal papillary mucinous tumor with dysplasia
2.3 Pseudopapillary solid tumor
การแบ่งระยะของมะเร็ง
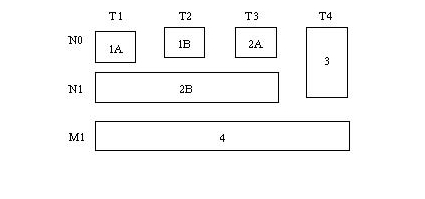
ใช้วิธีการแบ่งตาม American Joint Committee on Cancer (AJCC) ปี 2002 ดังตารางที่ 1 และ 2(20) ซึ่งบอกการพยากรณ์โรคได้ดี การแบ่งระยะโรคมะเร็งโดย Kawarada(21) มีประโยชน์ในการวางแผนการรักษามากกว่า โดยแบ่งเป็น 3 กลุ่มคือ กลุ่มแรก ระยะที่ผ่าตัดก้อนมะเร็งได้ กลุ่มที่สองระยะเป็นมากเฉพาะที่ และกลุ่มที่สามระยะมะเร็งแพร่กระจายเกณฑ์ในการวินิจฉัยมะเร็งระยะผ่าตัดได้คือ
1. ไม่มีการกระจายของมะเร็ง
2. ก้อนมะเร็งไม่โอบรอบเส้นเลือดแดง celiad หรือ superior mesenteric
3. ก้อนมะเร็งไม่โอบรอบเส้นเลือดดำ superior mesenteric และ portal
ตารางที่ 1 TNM Classification ของมะเร็งตับอ่อน
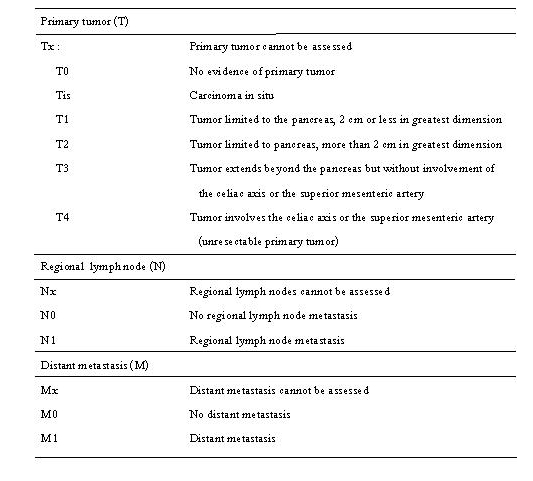
ตารางที่ 2 AJCC Stage grouping ของมะเร็งตับอ่อน
การพยากรณ์โรค
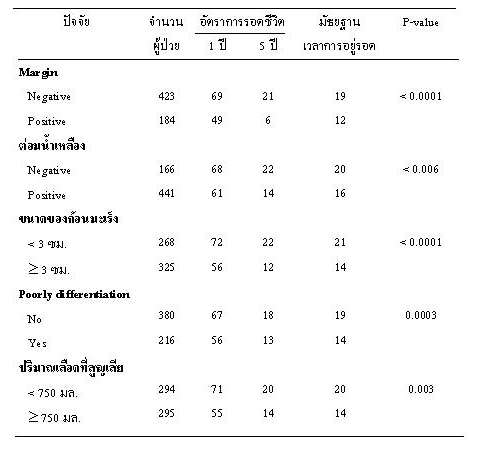
ขนาดของก้อนมะเร็ง การลุกลามของมะเร็งไปที่ต่อมน้ำเหลือง(22,23,24) การลุกลามไปยังปลายประสาทการผ่าตัดเพื่อให้ได้ขอบเขตที่เพียงพอ การสูญเสียเลือดระหว่างผ่าตัด(25) และผลทางพยาธิวิทยา(26) มีผลต่ออัตราการรอดชีวิตของผู้ป่วยตามตารางที่ 3(26)
ตารางที่ 3 แสดงปัจจัยที่มีผลต่ออัตราการรอดชีวิตในผู้ป่วยมะเร็งตับอ่อนหลังการทำผ่าตัด pancreaticoduodenectomy
มะเร็งตับอ่อนระยะที่ผ่าตัดได้ (resectable pancreatic cancer)
เนื่องจากการกำเริบเฉพาะที่และการกระจายของโรคมะเร็งยังคงเป็นสาเหตุการเสียชีวิตที่สำคัญในผู้ป่วยที่ได้รับการผ่าตัดแล้วจึงมีความพยายามให้ปรับปรุงการรักษาโดยหวังผลเพิ่มอัตราการควบคุมโรคเฉพาะที่ และอัตราการรอดชีวิต เช่น การผ่าตัดกว้างขึ้น (extended surgical resection) การฉายรังสีระหว่างผ่าตัด (intraoperative radiotherapy; IORT) การให้รังสีเคมีบำบัด การให้ยาเคมีบำบัดในช่องท้อง (intraperitioneal chemotherapy) และการให้รังสีป้องกันการลุกลามบริเวณตับ (prophylactic hepatic irradiation) แต่พบว่ามีเพียงการให้รังสีเคมีบำบัด และ IORT เท่านั้นที่มีการศึกษามากในงานวิจัยแบบเปรียบเทียบดังจะได้กล่าวถึงต่อไป
การใช้รังสีเคมีบำบัดเป็นการรักษาเสริมภายหลังการทำ Whipple's operation มีการศึกษาซึ่งเป็นการศึกษาเปรียบเทียบ (randomized controlled trial) รายงานตั้งแต่ปี 1985 โดย Gastrointestinal Tumor Study Group (GITSG)(27) ทำการศึกษาผลการรักษาผู้ป่วยมะเร็งตับอ่อนที่ผ่าตัดแล้ว โดยแบ่งผู้ป่วยเป็นกลุ่มแรกผู้ป่วยจำนวน 22 ราย เป็นกลุ่มควบคุมให้การผ่าตัดอย่างเดียว และผู้ป่วยกลุ่มที่ 2 จำนวน 21 ราย ซึ่งได้รับการผ่าตัดตามด้วยฉายรังสี 40 Gy (2 Gy ต่อครั้ง 10 ครั้ง พัก 2 สัปดาห์ แล้วฉายรังสีต่ออีก 2 Gy 10 ครั้ง) ร่วมกับยาเคมี 5FU ปริมาณ 500 มก/ตร.ม/วัน ใน 3 วันแรกของการฉายรังสีแต่ละรอบ และให้ยาเคมี 5FU เสริมจนครบ 2 ปี
พบว่ากลุ่มที่ได้รับรังสีเคมีบำบัดเสริมมีอัตราการอยู่รอดที่ 2 ปี และ 5 ปี เท่ากับ 43% และ 19% (อัตราดังกล่าวในกลุ่มแรกเท่ากับ 15% และ 5% ตามลำดับ)(P<0.05) และมัธยฐานเวลาการอยู่รอด 20 เดือน (เปรียบเทียบกับ 11 เดือนในกลุ่มแรก) อย่างไรก็ตาม 71% ของผู้ป่วยทั้งหมดมีการกำเริบของโรคและครึ่งหนึ่งเป็นการกำเริบที่ตับ ซึ่งเป็นตัวบ่งชี้ว่าการให้รังสีเคมีบำบัดอาจจะมีประสิทธิภาพไม่เพียงพอในการควบคุมโรคเฉพาะที่ หลังจากนั้น GITSG(28) ทำการวิจัยเพิ่มโดยใช้รังสีเคมีบำบัดเสริมหลักการผ่าตัดในผู้ป่วยอีก 30 ราย พบว่า อัตราการอยู่รอดที่ 5 ปี และ 5 ปี เท่ากับ 43% และ 17% ตามลำดับโดยมีมัธยฐานเวลาการอยู่รอด 18 เดือน
สิ่งที่งานวิจัยนี้ไม่ได้ตอบคำถามคือ ประโยขน์การให้ยาเคมี 5FU เสริมอีก 2 ปีอย่างไรก็ตามจากความรู้ในปัจจุบันพอจะอนุมานได้ว่าการให้ยาเคมี 5FU เสริมไม่น่าจะมีผลในการรักษามากนัก เพราะงานวิจัยเปรียบเทียบรายงานโดย Burris ในปี 1997(29) ซึ่งศึกษาเปรียบเทียบระหว่างการให้ยา 5FU สัปดาห์ละครั้ง และการใช้ gemcitabine สัปดาห์ละครั้ง
ในมะเร็งตับอ่อนระยะลุกลาม ไม่พบว่าผู้ป่วยที่ได้รับยา 5FU จะมีการตอบสนองต่อการรักษาผลการวิจัยชิ้นที่ 2 รายงานโดย Klinkenbijl จาก EORTC(30) ในปี 1999 มีผู้ป่วย 207 ราย เป็นมะเร็งตับอ่อนหรือมะเร็งบริเวณรอบรูเปิดทางเดินน้ำดี (periampulla cancer) ได้รับการรักษาเสริมโดยแบ่งเป็นผู้ป่วยกลุ่มควบคุม 103 ราย ไม่ได้รับการรักษาเสริมและผู้ป่วยกลุ่มที่สอง 104 ราย ได้รับรังสีเคมีบำบัด โดยฉายรังสี 40 Gy (แบ่งฉายเป็น 2 รอบ) พร้อมกับยาเคมี 5 FU 25 มก/กก/วัน แต่ไม่ได้ให้ยา 5FU เสริมเหมือนกับงานวิจัยของ GITSG ผู้ป่วยในกลุ่มนี้ 20% ไม่ได้รับรังสีเคมีบำบัด เนื่องจากผู้ป่วยปฏิเสธ มีโรคทางอายุรกรรมหรือก้อนมะเร็งกำเริบขึ้นเร็ว
พบว่ากลุ่มที่ได้รับการรักษาเสริมมีมัธยฐานเวลาการรอดชีวิต 17.1 เดือน เมื่อเปรียบเทียบกับกลุ่มแรก 12.6 เดือน (P=0.099) เมื่อแยกวิเคราะห์เฉพาะผู้ป่วยมะเร็งตับอ่อน 119 ราย พบว่ากลุ่มที่ได้รับรังสีรักษาเสริมมีอัตราการรอดชีวิตที่ 2 ปี 39% (26% ในกลุ่มควบคุม) และมัธยฐานเวลาการรอดชีวิต 15.7 เดือน (12.9 เดือนในกลุ่มควบคุม) (P=0.12) ซึ่งไม่แตกต่างกันทางสถิติ ทั้งนี้ เชื่อว่าความไม่แตกต่างเกิดจาก poor compliance ในผู้ป่วยกลุ่มที่ได้รังสีเคมีบำบัดและงานวิจัยไม่มีกำลัง (power) พอที่จะตรวจพบความแตกต่างของอัตราการรอดชีวิตการศึกษาที่ 3 รายงานโดย Neoptolemos และคณะ (ESPAC-1)(31) มีผู้ป่วยทั้งหมด 541 ราย เป็นการศึกษาเพื่อตอบคำถามว่าการให้รังสีเคมีบำบัดเสริมหลังผ่าตัด การให้ยาเคมีบำบัดเสริมอย่างเดียว หรือการให้รังสีเคมีบำบัดตามด้วยยาเคมีบำบัดเสริมดีกว่าการผ่าตัดอย่างเดียวหรือไม่
ตารางการให้รังสีเคมีบำบัดคือ ฉายรังสี 20 Gy ใน 10 ครั้ง ร่วมกับยาเคมี 5FU 500 มก./ตร.ม./วัน ในวันที่ 1-3 ของการฉายรังสีหลังจากนั้น พัก 2 สัปดาห์แล้วให้ซ้ำด้วยตารางเดิม (รวมได้รังสีรักษา 40 Gy) สำหรับยาเคมีบำบัดให้ยา 5 FU 425 มก./ตร.ม./วัน และ Leucovorin 20 มก./ตร.ม./วัน เดือนละ 5 วัน เป็นเวลา 6 เดือน ผลการศึกษาพบว่าการใช้รังสีเคมีบำบัดเสริมไม่มีประโยขน์ในการเพิ่มอัตราการรอดชีวิต โดยมีมัธยฐานเวลาการรอดชีวิต 15.5 เดือน เปรียบเทียบกับ 16.1 เดือน ในกลุ่มที่ไม่ได้รังสีเคมีบำบัด (P=0.24) ในขณะที่การให้ยาเคมีบำบัดเสริมมีมัธยฐานเวลาการรอดชีวิต19.7 เดือน เปรียบเทียบกับ 14 เดือน ในกลุ่มที่ไม่ได้ยาเคมีบำบัดเสริม (P=0.0005) อย่างไรก็ตาม งานวิจัย ESPAC-1 นี้ได้รับการวิจารณ์ว่ากระบวนการสุ่ม (randomization) เปิดโอกาสให้ผู้ป่วยและแพทย์มีโอกาส เลือกกลุ่มของการรักษาเสริมและวิธีการทางการวิเคราะห์ข้อมูลทำให้มีความลำเอียงและทำให้ผลการวิจัยไม่น่าเชื่อถือ(32) จากผลการวิจัย ESPAC-1 ทำให้คณะผู้วิจัยจากทวีปยุโรปเริ่มทำการศึกาาถึงชนิดของยาเคมีบำบัดเสริมในงานวิจัย ESPAC-3 โดยทำในผู้ป่วยมะเร็งตับอ่อนที่ผ่าตัดแล้ว
โดยศึกษาเปรียบเทียบระหว่างกลุ่มที่ 1 ให้ยาเคมี 5FU ร่วมกับ Leucovorin กลุ่มที่ 2 ให้ยา Gemcitabine และกลุ่มที่ 3 เป็นกลุ่มควบคุมไม่ให้การรักษาเสริมซึ่งขณะนี้กำลังทำการศึกษาอยู่ Yeo และคณะ(7) จาก John Hopkins Medical Institution รายงานผลการวิจัยไปข้างหน้าในผู้ป่วยมะเร็งตับอ่อนส่วนหัว, คอ หรือ uncinate process ซึ่งได้รับการผ่าตัด pancreaticoduodencetomy แบ่งผู้ป่วยเป็น 3 กลุ่ม กลุ่มแรกมีผู้ป่วย 99 ราย ให้รังสีรักษา 40-50 Gy ร่วมกับยาเคมี 5FU bolus 3 วันแรกและ 3 วันสุดท้ายของการฉายรังสีต่อด้วยยาเคมี 5FU เสริม 500 มก./ตร.ม./ สัปดาห์ เป็นเวลา 4 เดือน กลุ่มที่สองมีผู้ป่วย 21 รายให้รังสีรักษา 50.4-57.6 Gy ที่บริเวณตับอ่อนและฉายรังสีป้องกัน บริเวณตับ (prophylactic hepatic irradiation) 23.4-27 Gy ร่วมกับยาเคมี 5FU (200 มก./ตร.ม./วัน) และ leucovorin (5 มก./ตร.ม./วัน) เป็นเวลา 4 เดือนและกลุ่มที่สามเป็นกลุ่มควบคุม มีผู้ป่วย 53 รายไม่ให้การรักษาเสริม
พบว่ากลุ่มที่ได้รับรังสีเคมีบำบัดเสริมมีมัธยฐานเวลาการรอดชีวิตเท่ากับ 19.5 เดือน ซึ่งดีกว่า 13.5 เดือนในกลุ่มควบคุมอย่างมีนัยสำคัญ (P=0.003) แต่มัธยฐานเวลาการรอดชีวิตของผู้ป่วยกลุ่มแรกและกลุ่มที่ 2 ไม่แตกต่างกัน 21 เดือน และ 17.5 เดือนตามลำดับรายงานการศึกษาย้อนหลัง(33,34) ในสถาบันเดียวกันที่ใหญ่ที่สุด ในการให้รังสีเคมีบำบัดเสริมหลังการผ่าตัด ได้แก่ รายงานของ Sohn และคณะจาก John Hopkins University มีผู้ป่วย 366 รายได้รับการให้รังสีเคมีบำบัดเสริมในขณะที่ 132 รายไม่ได้รับการรักษาเสริมจากหลายสาเหตุ
พบว่า การให้การรักษาเสริมสามารถเพิ่มเวลาการรอดชีวิตจาก 11 เดือน เป็น 19 เดือน (P<0.0001)Foo และคณะจาก Mayo Clinic(35) รายงานผลการศึกษาย้อนหลังในผู้ป่วยมะเร็งตับอ่อนที่ผ่าตัดออกได้หมด 29 ราย ซึ่งได้รับรังสีเคมีบำบัดเสริมโดยมีมัธยฐานของปริมาณรังสี 54 Gy ในจำนวนนี้ผู้ป่วย 9 รายได้รังสีแบบ split course และที่เหลือได้รับการฉายรังสีแบบปกติ ผู้ป่วย 27 รายได้รับยาเคมี 5FU Bolus พร้อมกับการฉายรังสีพบว่ามัธยฐานเวลาการรอดชีวิตเท่ากับ 22.8 เดือน และอัตราการรอดชีวิตที่ 2 ปี, 3 ปี และ 5 ปี เท่ากับ 48% 24% และ 12% ตามลำดับ มีการกำเริบของโรคที่ตับหรือเยื่อบุช่องท้อง 59%ในปี 2000 Nukui และคณะ(36) รายงานการศึกษาเปรียบเทียบระยะ 2 โดยให้การรักษาเสริมหลังจากทำการผ่าตัดPancreaticoduodenectomy ในผู้ป่วย 33 ราย
โดยผู้ป่วยกลุ่มแรก 16 รายใช้รังสีรักษา 45-54 Gy พร้อมกับยาเคมี 5FU และผู้ป่วยกลุ่มที่สอง 17 รายได้รับรังสีรักษา 45-54 Gy พร้อมกับยาเคมี 5FU 200 มก./กก./วัน, Cisplatin 30 มก./ตร.ม./สัปดาห์ และ Interfero-alpha 3x106 ยูนิต/วัน วันเว้นวัน พบว่ากลุ่มที่สองมีอ้ตราการรอดชีวิตที่ 2 ปี เท่ากับ 84% ในขณะที่กลุ่มแรกเท่ากับ 54% (P=0.04)ถึงแม้ไม่อาจกล่าวได้ว่าการให้รังสีเคมีบำบัดเสริม จะเป็นที่ยอมรับโดยสากล แต่ในทางปฏิบัติในทวีปอเมริกาเหนือเชื่อว่าการให้รังสีรักษาแบบ split course และการใช้ bolus 5FU นั้นไม่ถือว่าเป็นมาตรฐานการรักษา รายงานของ Poen และคณะ(37) พบว่าการฉายรังสีแบบต่อเนื่องและการใช้ 5FU continuous infusion ทำให้ผู้ป่วยได้รับยาเคมีสูงขึ้นประมาณ 2.5 เท่า และมีผลข้างเคียงระยะเฉียบพลันน้อยกว่าการให้ 5FU bolus RTOG ทำการศึกษาระยะที่ 3 (RTOG 97-04) ในผู้ป่วยมะเร็งตับอ่อนที่ผ่าตัดแล้ว โดยให้การรักษาเสริมภายใน 3-8 สัปดาห์ ดังรูปที่ 2 และได้ปิดการรับผู้ป่วยแล้ว ขณะนี้กำลังติดตามผลอยู่ โดยผลการศึกษาจะออกมาในไม่ช้ารูปที่ 2 แสดงการแบ่งกลุ่มและการรักษาในการศึกษาของ RTOG เกี่ยวกับการให้การรักษาเสริมในมะเร็งตับอ่อนระยะผ่าตัดได้
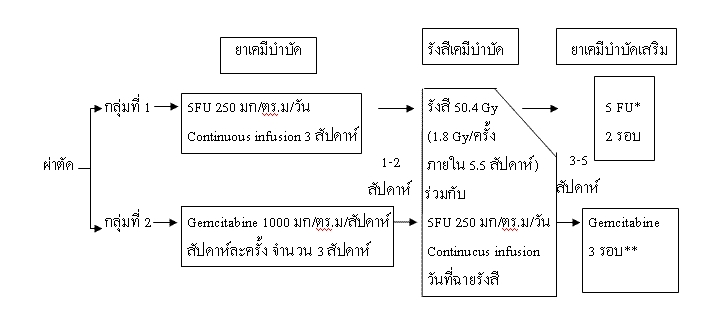
* 5FU 1 รอบ เท่ากับ 5 FU 250 มก/ตร.ม /วัน continuous infusion x 4 สัปดาห์ พัก 2 สัปดาห์
**Gemcitabine 1 รอบ เท่ากับ Gemcitabine 1000 มก/ตร.ม/สัปดาห์ x 3 สัปดาห์ เว้น 1 สัปดาห์
จากรายงานการศึกษาที่กล่าวแล้วข้างต้น ( ตารางที่ 4 ) ชี้ให้เห็นถึงประโยชน์ของการให้รังสีเคมีบำบัดเสริมหลังจากทำการผ่าตัดว่าสามารถช่วยลดอัตราการกำเริบเฉพาะที่ แต่การกระจายของมะเร็งไปที่ตับยังเป็นสาเหตุสำคัญของความล้มเหลวในการรักษา ซึ่งยังต้องรอผลการศึกษาวิธีการป้องกันการลุกลามในอนาคต
Poen(38) แนะนำว่าการให้ยาเคมีบำบัดเสริม (maintenance) ควรพิจารณาในผู้ป่วยที่มีการลุกลามที่ต่อมน้ำเหลือง,ไม่ได้ขอบเขตของการผ่าตัด (positive margin) และรายที่มี CA 19-9 สูงขึ้นหลังผ่าตัด
ตารางที่ 4 แสดงการศึกษาผลการให้รังสีเคมีบำบัดเสริมหลังผ่าตัดเปรียบเทียบกับการผ่าตัดอย่างเดียว
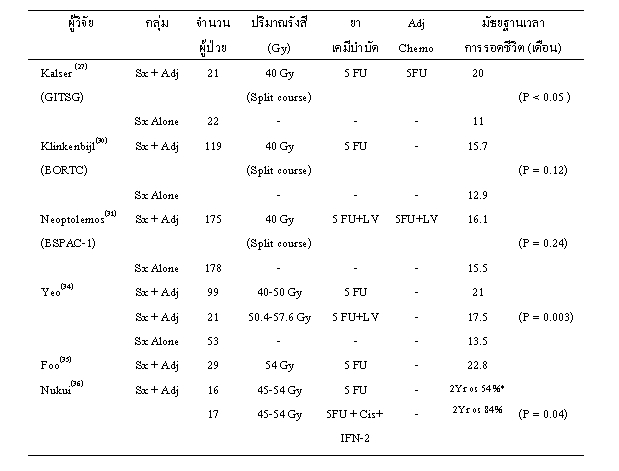
*2 yr os-อัตราการรอดชีวิตที่ 2 ปี
มะเร็งตับอ่อนที่ก้ำกึ่งว่าจะผ่าตัดได้หรือไม่ ( Marginally unresected tumor )นอกจากรังสีเคมีบัดสามารถใช้เป็นการรักษาเสริม ยังมีประโยชน์ในการให้การรักษาเสริมก่อนผ่าตัด (Neoadjuvant radiochemotherapy) ทั้งในผู้ป่วยที่ก้อนมะเร็งน่าจะผ่าตัดได้ และก้อนมะเร็งใหญ่เกินกว่าจะผ่าตัดได้ ซึ่งการให้การรักษาเสริมก่อนผ่าตัดมีข้อได้เปรียบคือ
1. ก้อนมะเร็งมีเลือดหล่อเลี้ยงดี ซึ่งทำให้รังสีรักษาได้ผลดี
2. สามารถป้องกันการกระจายหรือการฝังตัวในบริเวณที่จะได้รับการผ่าตัด
3. ทำให้ก้อนมะเร็งยุบตัวลงและอาจทำให้ผ่าตัดได้ง่ายขึ้น
4. ผู้ป่วยประมาณ 25% อาจมีการกระจายของมะเร็งหลังจากได้รังสีเคมีบำบัดนำ ซึ่งผู้ป่วยกลุ่มนี้เป็นกลุ่มที่มีการพยากรณ์โรคไม่ดีและอาจไม่จำเป็นต้องทำผ่าตัด(39)
5. การให้รังสีเคมีบำบัดสามารถให้ได้เต็มที่ ไม่ยืดเยื้อเหมือนดั่งกรณีให้รังสีเคมีบำบัดหลังผ่าตัด ซึ่งต้องรอให้ผู้ป่วยฟื้นตัวจากผ่าตัดก่อนเบื้องต้นจะกล่าวถึงการศึกษาในมะเร็งตับอ่อนระยะต้นก่อน (localized pancreatic cancer) Evans และคณะ(39) จาก M.D. Anderson Cancer Center รายงานผลการศึกษาในผู้ป่วย 28 ราย โดยให้รังสีเคมีบำบัดแล้วตามด้วยการผ่าตัด โดยปริมาณรังสีที่ใช้เท่ากับ 50.4 Gy (1.8 Gy/ครั้ง x 28 ครั้ง) พร้อมกับยาเคมีบำบัด 5FU 300 มก/ตร.ม/วัน (ให้ทุกวันที่ฉายรังสี) พบว่ามีผลข้างเคียงเช่น คลื่นไส้ อาเจียน ซึ่งทำให้ผู้ป่วยต้องนอนโรงพยาบาลประมาณหนึ่งในสาม ผู้ป่วย 5 ราย พบการกระจายของมะเร็งก่อนการผ่าตัดและมีผู้ป่วยเพียง 17 ราย ที่สามารถทำผ่าตัด pancreaticaduodenectomy ได้ในขณะที่ Staley(40) จากสถาบันเดียวกันรายงานว่าผู้ป่วยที่ได้รับการรักษาวิธีเดียวกันนี้มีอัตราการรอดชีวิตที่ 4 ปี เท่ากับ 19% มัธยฐานเวลาการรอดชีวิต 19 เดือนและพบการกำเริบเฉพาะที่เพียง 11% แต่มีการกระจายไปที่ตับถึง 53%
Hoffman(41) ทำการศึกษาระยะที่ 2 ในผู้ป่วยมะเร็งตับอ่อนระยะต้น 53 ราย โดยให้รังสี 50.4 Gy (1.8 Gy/ครั้ง) พร้อมกับยาเคมีบำบัด mitomycin C 10 มก/ตร.ม/วัน ในวันที่ 2 และ 5FU 100 มก/ตร.ม/วัน วันที่ 2-5 และ 29-32 ผู้ป่วย 51% จำเป็นต้องนอนโรงพยาบาลในระหว่าง ในระหว่างการฉายรังสี ผู้ป่วย 12 รายไม่ได้รับการผ่าตัด ผู้ป่วย 24 รายได้รับการผ่าตัดก้อนมะเร็งออกได้มัธยฐานเวลาการรอดชีวิตโดยรวม เท่ากับ 9.7 เดือน ในขณะที่ผู้ป่วยที่ได้รับการผ่าตัดมีมัธยฐานเวลาการรอดชีวิต 15.7 เดือน
การวิจัยเพื่อที่จะลดผลข้างเคียงต่อระบบทางเดินอาหาร และไม่ทำให้อัตราการควบคุมโรคเฉพาะที่แย่ลง รายงานโดย Pister และคณะ(42) โดยเปลี่ยนวิธีการฉายรังสีเป็นการฉายรังสีระยะสั้น 30 Gy (3Gy/ครั้ง x 10 ครั้ง ใน 2 สัปดาห์) ร่วมกับยาเคมี 5FU 300 มก/ตร.ม/วัน (ทุกวันที่ฉายรังสี) แล้วตามด้วยการผ่าตัดและการฉายรังสีระหว่างผ่าตัด (IORT) พบว่ามีอัตราการกำเริบเฉพาะที่เพียง 10% มัธยฐานเวลาการอยู่รอด 25 เดือน และอัตราการรอดชีวิตที่ 3 ปี เท่ากับ 23% ซึ่งได้ผลไม่แตกต่างกับการฉายรังสีแบบปกติ (5.5 สัปดาห์)
Breslin และคณะ(43) ทำการศึกษาในผู้ป่วย 132 ราย โดยแบ่งกลุ่มเป็น 2 กลุ่ม (non randomized) กลุ่มแรกผู้ป่วย 44 ราย ได้รับรังสีรักษาแบบมาตรฐาน (45-50 Gy) ผู้ป่วยกลุ่มที่ 2 จำนวน 88 ราย ได้รังสีรักษาระยะสั้น (30 Gy ; 3 Gy / ครั้ง) ร่วมกับยาเคมีบำบัดโดยใช้ยาเคมี 5FU 105 ราย, Paclitaxel 18 ราย, และ Gemcitabine 9 ราย ผู้ป่วย 74 รายได้รับการฉายรังสีระหว่างผ่าตัด (intraoperative radiation therapy) ร่วมด้วย พบว่ามีอัตราการกำเริบเฉพาะที่ 10% มัธยฐานเวลาการอยู่รอด 21 เดือน และอัตราการรอดชีวิตที่ 5 ปี เท่ากับ 23% และไม่พบความแตกต่างระหว่างการฉายรังสีแบบมาตรฐาน และการฉายรังสีระยะสั้น หรือชนิดของยาเคมีที่ให้
Spitz(44) และคณะ ทำการศึกษาย้อนหลังในผู้ป่วย 142 ราย เพื่อเปรียบเทียบระหว่างการให้รังสีเคมีบำบัดนำและการให้รังสีเคมีบำบัดหลังการผ่าตัด โดยใช้ตารางการฉายรังสีมาตรฐาน 50.4 Gy ในผู้ป่วย 27 ราย และใช้การฉายรังสีแบบเร่ง 30 Gy ในผู้ป่วย 14 ราย พบว่าไม่มีผู้ป่วยในกลุ่มที่ให้รังสีเคมีบำบัดนำจะต้องเลื่อนการผ่าตัดออกไป (delay surgery) ในขณะที่ผู้ป่วย 24% ในกลุ่มที่ผ่าตัดก่อนไม่สามารถรับรังสีเคมีบำบัดเสริมได้ และอัตราการกำเริบเฉพาะที่เท่ากับ 10% และ 21% ในกลุ่มที่ได้รังสีเคมีบำบัดก่อนและหลังการผ่าตัดตามลำดับ
ถึงแม้ว่าจะยังไม่มีการศึกษาเปรียบเทียบแบบ randomization เพื่อจะได้ทราบว่าการให้รังสีเคมีบำบัดเสริมก่อนหรือหลังการผ่าตัดจะดีที่สุดในผู้ป่วยมะเร็งตับอ่อนระยะต้น แต่จากข้อมูลที่กล่าวไปแล้วทำให้ทราบถึงข้อได้เปรียบของการให้รังสีเคมีบำบัดก่อนผ่าตัด อย่างไรก็ตามแพทย์ควรพิจารณาเลือกผู้ป่วยที่เหมาะสมกับการรักษาวิธีนี้เป็นรายๆ
มะเร็งตับอ่อนระยะที่ผ่าตัดไม่ได้ (Unresectable Pancreatic Tumor)
ผู้ป่วยมะเร็งตับอ่อนระยะที่ผ่าตัดไม่ได้ ได้แก่ ก้อนมะเร็งซึ่งมีการลุกลามไปยังเส้นเลือดแดงและเส้นเลือดดำที่อยู่ใกล้เคียงและบริเวณ mesenteric root ผู้ป่วยกลุ่มนี้ถึงแม้ว่าจะไม่สามารถรักษาให้หายขาดได้ แต่เป็นกลุ่มที่ท้าทายวิทยาการทางการแพทย์ การใช้รังสีปริมาณสูงถึง 65-75 Gy โดยการฉายรังสีแบบปกติไม่สามารถกระทำได้เนื่องจากอวัยวะสำคัญซึ่งอยู่ข้างเคียงไม่สามารถที่จะทนต่อรังสีปริมาณสูงได้จึงมีความพยายามหาวิธีการรักษาวิธีต่างๆ คือ การใช้รังสีเคมีบำบัด การฉายรังสี 3 มิติ (conformal radiation therapy) การฉายรังสีในห้องผ่าตัด (IORT) การฝั่งแร่ระยะใกล้ (brachytherapy) เพื่อทำให้ก้อนมะเร็งได้รับปริมาณรังสีสูงและเกิดผลข้างเคียงต่ออวัยวะข้างเคียงน้อยที่สุด ซึ่งจะได้กล่าวถึงในรายละเอียดต่อไป
GITSG(45) ทำการศึกษาวิจัยเปรียบเทียบในผู้ป่วย 194 ราย โดยแบ่งผู้ป่วยเป็น 3 กลุ่ม กลุ่มแรกฉายรังสีอย่างเดียว 60 Gy กลุ่มที่สอง ฉายรังสี 40 Gy พร้อมกับยาเคมี 5FU และกลุ่มที่สามฉายรังสี 60 Gy พร้อมกับยาเคมี 5FU โดยการฉายรังสีใช้เทคนิคการฉายรังสีแบบ split course (พัก 2 สัปดาห์ ทุก 20 Gy ; 2 Gy ต่อครั้งใน 10 ครั้ง ) พบว่ากลุ่มที่ฉายรังสีอย่างเดียวมีมัธยฐานเวลาการรอดชีวิต 5.5 เดือนในขณะที่กลุ่มที่ 2 และ 3 เท่ากับ 8.3 และ 11.3 เดือน ตามลำดับ งานวิจัยฉบับนี้ทำให้การให้รังสีเคมีบำบัดเป็นการรักษามาตรฐานในผู้ป่วยมะเร็งตับอ่อนระยะที่ผ่าตัดไม่ได้
ในทางตรงกันข้าม Eastern Cooperative Group Trial (ECOG)(46) ทำการศึกษาเปรียบเทียบในผู้ป่วยมะเร็งตับอ่อนที่ผ่าตัด ไม่ได้ 91 ราย ระหว่างการให้รังสีเคมีบำบัด (ปริมาณรังสี 40 Gy พร้อมกับ 5FU) 600 มก/ตร.ม/วัน ใน 3 วันแรกที่ฉายรังสี และให้ยาเคมี 5FU เสริมหลังฉายรังสีครบ 600 มก/ตร.ม/สัปดาห์ เปรียบเทียบกับการให้ยาเคมีบำบัด 5FU 600 มก/ตร.ม/สัปดาห์อย่างเดียว พบว่ามัธยฐานเวลาการอยู่รอดเท่ากันคือประมาณ 8.2 เดือน ซึ่งได้รับการวิจารย์ว่าเป็นผลจากจำนวนผู้ป่วยที่ทำการศึกษาน้อยและปริมาณรังสีที่ให้ไม่เพียงพอ
ECOG(47) ทำการวิจัยระยะที่ 1 เพื่อหาปริมาณยาเคมี 5FU ที่เหมาะสมเมื่อให้ร่วมกับการฉายรังสี 59.4 Gy (ใน 33 ครั้ง;ระยะเวลา 6-7 สัปดาห์) ในการรักษาผู้ป่วยมะเร็งตับอ่อนและท่อน้ำดีที่ผ่าตัดไม่ได้, เหลือก้อนมะเร็งหลังผ่าตัดและรายที่มีการกำเริบเฉพาะที่ จำนวน 25 ราย พบว่าขนาดของยาเคมี 5FU influsion ที่เหมาะสมคือ 250 มก/ตร.ม/วัน การศึกษาแบบ nonrandomization โดยให้การฉายรังสีพร้อมกับยาเคมีบำบัด 5FU และการเพิ่มยาเคมีบำบัดชนิดอื่น เช่น Adriamycin, Mitomycin, Cisplatin, Epirubicin (48-50) ยังไม่พบว่ามีประโยชน์ในการเพิ่มอัตราการรอดชีวิต เนื่องจากงานวิจัยเกี่ยวกับรังสีเคมีบำบัด โดยใช้ยา 5FU มีผลในการเป็น radiosensitizer ดังที่ได้กล่าวมาแล้ว จึงมีการศึกษาโดยการใช้ยา gemcitabine ร่วมกับการฉายรังสี โดยหวังผลเป็น radiosensitizer เช่นกัน การวิจัยแบ่งเป็น 2 วิธี คือ วิธีแรก การฉายรังสีด้วยขอบเขตคลุมก้อนมะเร็งและต่อมน้ำเหลืองแบบที่ทำกันอยู่ในปัจจุบัน แล้วหาปริมาณยาเคมี gemcitabine ที่เหมาะสม และวิธีที่สอง การใช้ยา gemcitabine ในขนาดปกติ แต่เปลี่ยนขอบเขตของการฉายรังสีหรือเปลี่ยนตารางการฉายรังสี ซึ่งรายละเอียดงานวิจัย ดังนี้
ในปี 1996 มีการวิจัยระยะที่ 1 จำนวน 2 ฉบับ(51,52) ซึ่งทำการศึกษาในผู้ป่วยมะเร็งระยะที่ผ่าตัดไม่ได้ โดยการฉายรังสี 50.4 Gy (ใน 28 ครั้ง) บริเวณที่ฉายรังสีคลุมก้อนมะเร็งและขอบเขต 3 ซม. จนถึง 39.6 Gy แล้วลดขอบเขตเหลือ 2 ซม. ถึง 50.4 Gy พร้อมกับการให้ยา gemcitabine สัปดาห์ละ 1 ครั้ง เพื่อหาปริมาณยาสูงสุดที่ผู้ป่วยทนได้ ( maximal tolerated dose; MTD ) พบว่า ที่ขนาดยา 700 มก./ตร.ม/สัปดาห์ มีผลข้างเคียงต่อระบบโลหิตวิทยาและทางเดินอาหารและขนาดยา 600 มก/ตร.ม/สัปดาห์ พบผลข้างเคียงระยะยาวโดยเกิด duodenal stricture ในผู้ป่วย 2 ใน 6 ราย และขณะนี้ยังไม่ได้ตีพิมพ์ผลว่า MTD เป็นเท่าไร(53)
ในปี 2001 Wolff(54) และคณะ ทำการวิจัยระยะที่ 1 เพื่อหาปริมาณยาเคมี gemcitabine เพื่อให้ร่วมกับการฉายรังสีแบบเร่ง 30 Gy (ใน 10 ครั้ง) พบว่า ผลข้างเคียงต่อระบบทางเดินอาหารสูงขึ้นมากเมื่อใช้ยา gemcitabine > 400 มก/ตร.ม/สัปดาห์ โดยขอบเขตการฉายรังสีในการวิจัยนี้คลุมก้อนมะเร็งและขอบเขต 3-5 ซม. รวมถึงต่อมน้ำเหลือง porta hepatis และ celiac ตารางการฉายรังสีและให้ยาเคมีเป็นไปตามรูปที่ 3
รูปที่ 3 แสดงตารางการให้ยาเคมีบำบัดร่วมกับการฉายรังสีในงานวิจัยของ Wolff
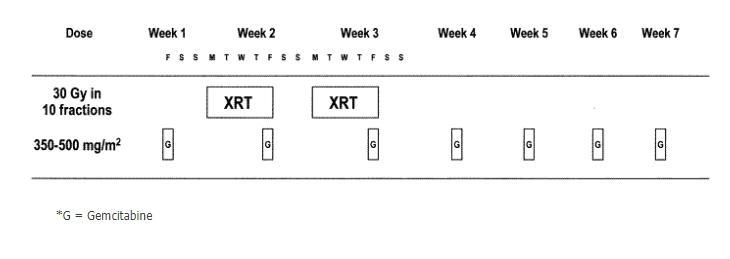
*G = Gemcitabine
Talamonti(55) รายงานผลการวิจัยระยะที่ 1 เพื่อหาปริมาณยา gemcitabine เมื่อให้ร่วมกับยาเคมี 5FU infusion 200 มก/ตร.ม/วัน ตลอดระยะเวลาการฉายรังสี 59.4 Gy (ใน 33 ครั้ง) โดยขอบเขตของการฉายรังสีคลุมก้อนมะเร็งและต่อมน้ำเหลือง พบว่าแม้จะลดขนาดยา gemcitabine เหลือเพียง 50 มก/ตร.ม/สัปดาห์ ก็ยังพบผลข้างเคียงต่อระบบทางเดินอาหารในผู้ป่วยมากถึง 3 ใน 7 ราย งานวิจัยระยะที่1/2 อื่นๆ ดูตารางที่ 5
งานวิจัยต่อไปนี้ (56) เป็นการใช้ยาเคมี gemcitabine ขนาด 1000 มก/ตร.ม/สัปดาห์ ซึ่งเป็นขนาดซึ่งให้ผลเป็น radiosensitizer มากที่สุด(57) โดยให้ในวันจันทร์ร่วมกับการฉายรังสี 3 มิติ (3-D Conformal radiation therapy) บริเวณฉายรังสีคือ ก้อนมะเร็งและขอบเขต 1 ซม. และไม่ฉายรังสีบริเวณต่อมน้ำเหลือง การศึกษาทำในผู้ป่วยมะเร็งตับอ่อนระยะที่ผ่าตัดไม่ได้ 34 ราย และผ่าตัดไม่หมด 3 ราย พบว่าผลข้างเคียงในระบบทางเดินอาหารเป็น dose limiting toxicity คืออาการคลื่นไส้ อาเจียน grade 4 ในผู้ป่วยที่ฉายรังสีปริมาณ 30 Gy (ใน 15 ครั้ง) 1 รายและที่ปริมาณรังสี 42 Gy (ใน 15 ครั้ง) 1 ราย ผู้ป่วยที่ได้รังสี 42 Gy (ใน 15 ครั้ง) อีก 1 รายมีแผลที่กระเพาะอาหารและลำไส้เล็ก เมื่อติดตามผู้ป่วยได้ 22 เดือนพบการกำเริบเฉพาะที่ 7 ราย, การกำเริบบริเวณต่อมน้ำเหลืองข้างเคียง 3 ราย และการแพร่กระจายของโรค 25 รายจาก 37 ราย โดยมีผู้ป่วยเพียง 1 รายเท่านั้นที่มีการกำเริบเฉพาะที่แต่ไม่มีการแพร่กระจายของโรค ผู้วิจัยสรุปว่าการฉายรังสี เฉพาะบริเวณก้อนมะเร็ง เมื่อให้ร่วมกับยาเคมี gemcitabine ในขนาด 1000 มก/ตร.ม/สัปดาห์ สามารถทำได้ แต่ต้องระวังผลข้างเคียงของทางเดินอาหาร และขณะนี้กำลังดำเนินการวิจัยระยะที่ 2
ตารางที่ 5 แสดงงานวิจัยระยะที่ 1 และ 2 โดยใช้รังสีเคมีบำบัด (gemcitabine) ในมะเร็งตับอ่อน

*Gemcitabine 24-hour infusion ในวันแรกของสัปดาห์ ยกเว้นสัปดาห์ที่ 4
เทคนิคทางรังสีรักษา
เทคนิคทางรังสีรักษาในผู้ป่วยที่ไม่สามารถผ่าตัดก้อนมะเร็งออกได้ Target volume สามารถดูได้จากภาพ CT scan โดยจะต้องฉายรังสีคลุมทั้งก้อนมะเร็งและต่อมน้ำเหลืองข้างเคียง โดยมีการเปิดขอบเขตออกไปอย่างน้อย 2 ซม. การให้ผู้ป่วยกินสารทึบรังสี ทำให้สามารถเห็นก้อนมะเร็งบริเวณลำตัวและหางของตับอ่อน มีขอบเขตการฉายรังสีคล้ายกับมะเร็งตับอ่อนส่วนหัว และต้องฉายรังสีคลุมต่อมน้ำเหลืองบริเวณขั้วม้าม แต่ไม่ต้องฉายรังสีคลุมต่อมน้ำเหลืองบริเวณ porta hepatis และบริเวณ C-loop ของ duodenum ดังนั้น ขอบขวาของการฉายรังสีหน้า-หลัง อยู่ที่ 2 ซม. ห่างจากขอบขวาของกระดูกสันหลังโดยระวังไม่ให้ฉายรังสีถูกไตข้างขวา ขอบซ้ายเลื่อนมาคลุมบริเวณขั้วม้ามสำหรับขอบบนอาจต้องเลื่อนสูงขึ้นไป เพื่อให้คลุมส่วนหางของตับอ่อน ดังรูปที่ 5 และ 6
เทคนิคทางรังสีรักษาในผู้ป่วยที่สามารถผ่าตัดก้อนมะเร็งออกได้
การฉายรังสีหลังผ่าตัดใช้แนวทางเดียวกันกับการฉายรังสีกรณีผ่าตัดไม่ได้ โดยดูจากภาพ CT scan ของก้อนมะเร็ง ก้อนมะเร็ง ก่อนผ่าตัดเป็นหลัก และหากศัลยแพทย์วาง clip ในบริเวณที่เคยมีก้อนมะเร็งหรือต่อมน้ำเหลืองจะช่วยให้แพทย์รังสีรักษา วางขอบเขตของการฉายรังสีได้ง่ายขึ้น ในกรณีที่ผ่าตัดก้อนมะเร็งได้หมด ปริมาณรังสีที่ใช้อยู่ระหว่าง 45-50.4 Gy และหากมีก้อนมะเร็งเหลืออยู่มากอาจต้องเพิ่มปริมาณรังสีขึ้นไปประมาณ 60 Gyโดยอาจดูจาก Clip ที่ศัลยแพทย์วางขอบเขตของก้อนมะเร็งที่ตัดไม่หมด หรือทำ CT scan หลังจากผ่าตัดเพื่อช่วยกำหนดขอบเขตของก้อนที่เหลืออยู่ในการ Boost บริเวณที่ก้อนมะเร็ง
รูปที่ 5 แสดงการฉายรังสีคลุมบริเวณลำตัวของตับอ่อน Anterior-posterior

รูปที่ 6 แสดงการฉายรังสีคลุมบริเวณหางของตับอ่อน Anterior-posterior ft lateral

การฉายรังสี 3 มิติ
บทบาทของการฉายรังสี 3 มิติ ( 3-D Conformal radiation therapy ) ในการรักษามะเร็งตับอ่อนยังไม่ชัดเจน และยังไม่มีรายงานทางคลินิคซึ่งวิเคราะห์ถึงข้อได้เปรียบของการกระจายของปริมาณรังสีในตับอ่อนว่าจะดีกว่างการฉายรังสีแบบที่ใช้อยู่ในปัจจุบัน (conventional radiation therapy) อย่างไรก็ตามเชื่อว่าการฉายรังสี 3 มิติสามารถช่วยลดผลข้างเคียงของการรักษา(61) โดยเฉพาะอย่างยิ่งเมื่อให้รังสีเคมีบำบัด และอาจจะทำให้สามารถเพิ่มปริมาณรังสีให้กับก้อนมะเร็งได้ นอกจากนี้อาจทำให้บรรเทาอาการปวดได้ดีขึ้น (62) ปัจจุบันยังไม่มีการพิสูจน์ว่าการเพิ่มปริมาณรังสีในปริมาณสูงจะช่วยเพิ่มอัตราการรอดชีวิตของผู้ป่วย ทั้งนี้ส่วนหนึ่งเป็นเพราะผู้ป่วยมักจะเสียชีวิตจากการกระจายของมะเร็ง การเคลื่อนที่ของอวัยวะตามการหายใจหรือตารมการขยายตัวของกระเพาะอาหารและลำไส้เป็นปัญหาหนึ่งของการฉายรังสี 3 มิติ พบว่าบริเวณตับอ่อนส่วนหาง เส้นเลือดแดง superior mesenteric(63) ไตและตับมีการเคลื่อนไหวในแบบหัว-ท้าย ( cranio-caudal ) ได้ถึง 1.7-2.4 ซม.(64) การใช้วิธีการฉายรังสีปรับตามการหายใจ (respiratory-gated radiation therapy) อยู่ระหว่างการพัฒนา(65)
การฝังแร่ระยะใกล้
ในการรักษามะเร็งตับอ่อนระยะที่ผ่าตัดไม่ได้โดยใช้การฝังแร่ระยะใกล้ (interstitial brachytherapy) ด้วยแร่ Iodine125 และpalladium103 แล้วตามด้วยการฉายรังสีภายนอก ช่วยให้แพทย์สามารถเพิ่มปริมาณรังสีบริเวณก้อนมะเร็งได้สูงกว่า 70 Gy ซึ่งในทางทฤษฏีสามารถเพิ่มโอกาสที่จะควบคุมโรคเฉพาะที่ได้สูงขึ้น
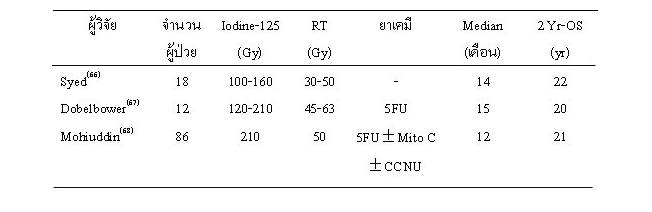
Syed และคณะ(66) รายงานผลการรักษาผู้ป่วยมะเร็งตับอ่อนระยะที่ผ่าตัดไม่ได้ จำนวน 18 ราย โดยการฝังแร่ iodine-125 ปริมาณ 100-160 Gy แล้วตามด้วยการฉายรังสี 30-50 Gy พบว่ามีมัธยฐานเวลาการรอดชีวิต 14 เดือน และช่วยควบคุมอาการปวดได้ในผู้ป่วย 16 ราย
Dobelbower และคณะ(67) รายงานผลการรักษาผู้ป่วยมะเร็งตับอ่อนระยะที่ผ่าตัดไม่ได้ 12 ราย โดยฝังแร่ Iodine-125 ปริมาณ 120-210 Gy แล้วตามด้วยการฉายรังสี 48.6-63 Gy และให้ยาเคมี 5FU bolus เสริม ผู้ป่วย11 รายได้รับการผ่าตัด gastrointestinal biliary bypass พบว่ามีมัธยฐานเวลาการรอดชีวิต 15 เดือน สามารถควบคุมอาการปวดในผู้ป่วยที่มาด้วยอาการปวด 6 ใน 10 ราย พบผลแทรกซ้อนจากการรักษาคือ pancreatic fistula 2 ราย, เลือดออกในทางเดินอาหาร ท่อน้ำดีอักเสบ และ pulmonary embolism อย่างละ1 ราย
Mohiuddin รายงาน(68) ประสบการณ์การฝังแร่จาก Thomas Jefferson University ผู้ป่วยมะเร็งตับอ่อนระยะที่ผ่าตัดไม่ได้ 13 รายแรกได้รับการฝังแร่ iodine-125 ปริมาณ 120 Gy แล้วตามด้วยการฉายรังสี 50-60 Gy ผู้ป่วย 19 รายได้รับการฝังแร่และฉายรังสี เช่นเดียวกับกลุ่มแรกและให้ยาเคมีเสริม (5FU + mitomycin + CCNU) ผู้ป่วยกลุ่มนี้มีการแพร่กระจายของมะเร็งมีอัตราสูง จึงปรับเปลี่ยนเป็นวิธีการฉายรังสีก่อนผ่าตัด 5 Gy ฝังแร่ 120 Gy และฉายรังสี 50 Gy ร่วมกับยาเคมี 5FU แล้วตามด้วยยาเคมีบำบัดเสริม (5FU, mitamycin C, CCNU) โดยมีผู้ป่วยกลุ่มสุดท้ายนี้ 54 ราย พบว่ามีมัธยฐานเวลาการรอดชีวิต 5.5, 11.4 และ 12.5 เดือน ตามลำดับกลุ่ม และมีอัตราการอยู่รอดที่ 2 ปี เท่ากับ 0, 15 และ 22% ตามลำดับ อัตราการควบคุมโรคเฉพาะที่โดยรวมเท่ากับ 84% แต่การแพร่กระจายโดยเฉพาะอย่างยิ่งที่ตับ ยังมีสูงถึง 64% แม้ว่าจะได้รับยาเคมีบำบัดร่วมด้วย ตารางที่ 6 สรุปผลการศึกษาการฝังแร่ระยะใกล้ ร่วมกับการฉายรังสีในการรักษามะเร็งตับ่ออนระยะที่ผ่าตัดไม่ได้
ตารางที่ 6 สรุปผลการศึกษาการฝังแร่ระยะใกล้ร่วมกับการฉายรังสีในการรักษามะเร็งตับอ่อนระยะที่ผ่าตัดไม่ได้

การฉายรังสีระหว่างผ่าตัด (Intraoperative Irradiation)
การฉายรังสีระหว่างผ่าตัด มีข้อได้เปรียบคือสามารถเห็นก้อนมะเร็งและบริเวณข้างเคียงที่มีความเสี่ยงสูงต่อการแพร่กระจาย ซึ่งทำให้แพทย์กำหนดบริเวณการฉายรังสีได้ถูกต้อง ในขณะเดียวกันยังสามารถใช้วัสดุกำบังรังสีกันอวัยวะที่ไม่ต้องการให้ถูกรังสี เช่น ลำไส้ กระเพาะอาหาร ไม่ให้ได้รับรังสี
โดย Abe(69) และคณะ รายงานผลการรักษาโดยการฉายรังสีระหว่างผ่าตัดในผู้ป่วยมะเร็งตับอ่อนระยะที่ผ่าตัดไม่ได้โดยใช้รังสีอิเล็กตรอน โดยแบ่งกลุ่มเป็น กลุ่มแรกผู้ป่วยได้รับการผ่าตัดอย่างเดียว 41 รายเป็นกลุ่มควบคุม กลุ่มที่ 2 มีผู้ป่วย 20 ราย ได้รับการผ่าตัด, ฉายรังสีระหว่างผ่าตัด 10-25 Gy และฉายรังสีภายนอก 35-50 Gy กลุ่มที่ 3 มีผู้ป่วย 49 รายได้รับการผ่าตัดและการฉายรังสีระหว่างผ่าตัด 25-40 Gy และกลุ่มที่ 4 มีผู้ป่วย 34 รายได้รับการผ่าตัดและการฉายรังสีภายนอก 55-60 Gy พบว่ามีมัธยฐานเวลาการรอดชีวิตเท่ากับ 5.5, 12, 5.5 และ 9 เดือนตามลำดับ ผลข้างเคียงรุนแรงคือ ถ่ายอุจจาระเป็นเลือด พบได้ 30% ในผู้ป่วยที่ได้รับการฉายรังสีระหว่างผ่าตัดมากกว่า 25 Gy ผู้ป่วย 10% มีแผลบริเวณ duodenum ผู้วิจัยแนะนำการรักษามะเร็งตับอ่อนระยะที่ผ่าตัดไม่ได้ โดยการผ่าตัด Bypass ร่วมกับการฉายรังสีระหว่างผ่าตัด 20-25 Gy แล้วตามด้วยการฉายรังสีภายนอก 40-50 Gy
Roldan และคณะ(70) รายงานประสบการณ์จาก Mayo Clinic ในการรักษาผู้ป่วยมะเร็งตับอ่อน 37 ราย โดยการฉายรังสีระหว่างผ่าตัด 20 Gy ร่วมกับการฉายรังสีภายนอก 45-55 Gy เปรียบเทียบกับผู้ป่วย 122 ราย ที่ได้รับการฉายรังสีอย่างเดียว 40-60 Gy พบว่า มัธยฐานเวลาการรอดชีวิตเท่ากับ 13.4 และ 12.6 เดือน ตามลำดับ อัตราการรอดชีวิตที่ 2 ปี เท่ากับ 12% และ 16% ตามลำดับ ในขณะที่อัตราการควบคุมโรคเฉพาะที่ที่ 2 ปี เท่ากับ 66% และ 20% (P = 0.0005) การควบคุมโรคเฉพาะที่ซึ่งสูงไม่ได้ทำให้อัตราการรอดชีวิตสูงขึ้นเพราะผู้ป่วยมีการลุกลามบริเวณช่องท้องถึง 54 และ 56% ตามลำดับ
Garton และคณะ(71) จาก Mayo Clinic รายงานผลการรักษาผู้ป่วยมะเร็งตับอ่อนระยะที่ผ่าตัดไม่ได้ 27 ราย โดยการฉายรังสีก่อนผ่าตัด 50-54 Gy พร้อมกับยาเคมี 5FU bolus แล้วตามด้วยการผ่าตัดและการฉายรังสีระหว่างผ่าตัด 20 Gy พบว่ามัธยฐานเวลาการรอดชีวิตเท่ากับ 14.9 เดือน อัตราการอยู่รอดที่ 2 ปี เท่ากับ 27% อัตราการกำเริบเฉพาะที่ 22% ปัญหาการแพร่กระจายที่ตับและผนังหน้าท้องยังสูงถึง 52%
Teppu และคณะ(72) (RTOG 85-05) รายงานผลการศึกษาระยะที่ 1-2 ในผู้ป่วยมะเร็งตับอ่อนระยะที่ผ่าตัดไม่ได้จำนวน 86 ราย โดยการฉายรังสีระหว่างผ่าตัด 20 Gy และฉายรังสีภายนอก 50.4 Gy ร่วมกับเคมี 5FU bolus ในจำนวนนี้ผู้ป่วยเพียง 51 รายที่สามารถ วิเคราะห์ผลการรักษาได้ พบว่ามัธยฐานเวลาการรอดชีวิตเท่ากับ 9 เดือน อัตราการรอดชีวิตที่ 1.5 ปี เท่ากับ 9%
สรุป
ผู้ป่วยมะเร็งตับอ่อนส่วนใหญ่มาพบแพทย์เมื่อก้อนมะเร็งมีขนาดใหญ่และมักจะไม่สามารถผ่าตัดก้อนมะเร็งออกได้ รังสีเคมีบำบัดมีบทบาทในการช่วยควบคุมโรคเฉพาะที่และช่วยในการรักษาแบบประคับประคอง ยาเคมีบำบัดที่ใช้เป็นมาตรฐานเมื่อให้ร่วมกับรังสีรักษาคือ 5FU สำหรับยาเคมี gemcitabine ซึ่งมีบทบาทในมะเร็งตับอ่อนระยะลุกลามกำลังได้รับการศึกษาเพื่อนำมาใช้ร่วมกับรังสีรักษา ผู้ป่วยที่มีก้อนมะเร็งอยู่ในระยะผ่าตัดได้ ควรได้รับการรักษาเสริมโดยรังสีเคมีบำบัด เพื่อช่วยเพิ่มอัตราการควบคุมโรค และอัตราการรอดชีวิตอย่างไรก็ตามทางยุโรปเชื่อว่าการให้ยาเคมีบำบัดเสริมอย่างเดียวเพียงพอในการรักษาเสริม
| 1. | King Chulalongkorn Memorial Hospital. Tumor registry 2000-2001. |
| 2. | Rosenberg JM, Welch JP, Macauley WP. Cancer of the head of the pancreas: an institutional review with emphasis on surgical therapy. J Surg Oncol 1985 Mar; 28 (3): 217-221. |
| 3. | Funovics JM, Karner J, Pratschner T, Fritsch A. Current trends in the management of carcinoma of the pancreatic head. Hepatogastroenterology 1989 Dec; 36 (6): 450-455. |
| 4. | Singh SM, Longmire WP Jr, Reber HA. Surgical palliation for pancreatic cancer. The UCLA experience. Ann Surg 1990 Aug; 212 (2): 132-139. |
| 5. | Trede M, Schwall G, Saeger HD. Survival after pancreatoduodenectomy. 118 consecutive resection without an operative mortality. Ann Surg 1990 Apr; 211 (4): 447-458. |
| 6. | Cameron JL, Crist DW, Sitzmann JV, et al. Factors influencing survival after pancreaticoduodenectomy for pancreatic cancer. Am J Surg 1991 Jan; 161 (1): 120-125. |
| 7. | Yeo CJ, Abrams RA, Grochow LB, et al. Pancreaticoduodenectomy for pancreatic adenocarcinoma: postoperative adjuvant chemoradiation improves survival. A prospective, single-institution experience. Ann Surg 1997 May; 225 (5): 621-636. |
| 8. | Whittemore AS, Paffenbarger RS Jr, Anderson K, et al. Early precursors of pancreatic cancer in college men. J Chronic Dis 1983; 36(3): 251-256 |
| 9. | Best EW, Walker CB, Baker PM, et al. Summary of a canadian study of smoking and health.CMAJ 1967; 96: 1104-1108. |
| 10. | Howe GR, Burch JD. Nutrition and pancreatic cancer. Cancer Causes Control 1996 Jan; 7(1): 69-82. |
| 11. | Gold EB. Epidemiology of and risk factors for pancreatic cancer. Surg Clin North Am 1995 Oct; 75(5): 819-843. |
| 12. | Garabrant DH, Held J, Langholz B, et al. DDT and related compounds and risk of pancreatic cancer. J Natl Cancer Inst 1992 May; 84(10): 764-771. |
| 13. | Mancuso TF, el-Attar AA. Cohort study of workers exposed to betanaphthylamine and benzidine. J Occup Med 1967 Jun; 9(6): 277-285. |
| 14. | Ahlgren JD. Epidemiology and risk factors in pancreatic cancer. Semin Oncol 1996 Apr; 23(2): 241- 250. |
| 15. | Krause JR, Ayuyang HQ, Ellis LD. Secondary non-hematopoietic cancers arising following treatment of hematopoietic disorders. Cancer 1985 Feb; 55(3): 512-515. |
| 16. | Everhart J, Wright D. Diabetes mellitus as a risk factor for pancreatic cancer. A meta-analysis. JAMA 1995 May; 273(20): 1605-1609. |
| 17. | Gullo L, Pezzilli R, Morselli-Labate AM. Diabetes and the risk of pancreatic cancer. Italian Pancreatic Cancer Study Group. N Engl J Med 1994 Jul; 331(2): 81-84. |
| 18. | Gold EB, Cameron JL. Chronic pancreatitis and pancreatic cancer. N Engl J Med 1993 May; 328(20) :1485-1486. |
| 19. | Hruban RH, Petersen GM, Goggins M, et al. Familial pancreatic Cancer. Ann Oncol 1999; 10 ( Supp 4 ): 69-73. |
| 20. | Exocrine pancreas. In : American Joint Committee on Cancer: AJCC Cancer Staging Mannual 6th ed. New York, NY: Springer, 2002, pp 157-164. |
| 21. | Kawarada Y, Isaji S. Stage classifications of pancreatic cancer: comparison of the Japanese and UICC classifications and proposal for a new staging system. Union Internationale Contre le Cancer. Pancreas 1998 Apr; 16(3): 255-264. |
| 22. | Takeuchi M, Kondos, Sugiura H, et al. Pre-operative predictors of short-term survival after pancreatic cancer resection. Hepatogastroenterology 1998 Nov-Dec; 45(24): 2399-2403. |
| 23. | Ozaki H, Hiraoka T, Mizumoto R, et al. The prognostic significance of lymph node metastasis and intrapancreatic perineural invasion in pancreatic cancer after curative resection. Surg Today 1999; 29(1): 16-22. |
| 24. | Birk D, Fortnagel G, Formentini A, et al. Small carcinoma of the pancreas. Factors of prognostic relevance. J Hepatobiliary Pancreat Surg 1998; 5(4): 450-454. |
| 25. | Millikan KW, Deziel DJ, Silverstein JC, et al. Prognostic factors associated with resectable adenocarcinoma of the head of the pancreas. Am Surg 1999 Jul; 65(7): 618-624. |
| 26. | Sohn TA, Yeo CJ, Cameron JL, et al. Resected adenocarcinoma of the pancreas-616 patients: results, outcomes, and prognostic indicators. J Gastrointest Surg 2000; 4: 567-579. |
| 27. | Kalser MH, Ellenberg SS. Pancreatic cancer: Adjuvant combined radiation and chemotherapy following curative resection. The Gastrointestinal Tumor Study Group. Arch Surg 1985 Aug; 120 (8): 899-903. Erratum in : Arch Surg 1986 Sep; 121 (9): 1045. |
| 28. | Gastrointestinal Tumor Study Group. Further evidence of effective adjuvant combined radiation and chemotherapy following curative resection of pancreatic cancer. Cancer 1987 Jun; 59 (12): 2006-2010. |
| 29. | Burris HA, Moore MJ, Andersen J, et al. Improvements in survival and clinical benefit with gemcitabine as first-line therapy for patients with advanced pancreas cancer: a randomized trial. J Clin Oncol 1997 Jun; 15(6): 2403-2413. |
| 30. | Klinkenbijl JH, Jeekel J, Sahmoud T, et al. Adjuvant radiotherapy and 5-fluorouracil after resection of cancer of the pancreas and periampullary region: phase III trial of the EORTC gastrointestinal tract cancer cooperative group. Ann Surg 1999 Dec; 230 (6): 776-782. |
| 31. | Neoptolemos JP, Dunn JA, Stocken DD, et al. Adjuvant chemoradiotherapy and chemotherapy in resectable pancreatic cancer: a randomised controlled trial. Lancet 2001 Nov; 358 (9293): 1576-1585. |
| 32. | Abrams RA. Adjuvant therapy for pancreatic adenocarcinoma: what have we learned since 1985 ? Int J Radiat Oncol Biol Phys 2003; 56 (4 suppl ): 3-9. |
| 33. | Sohn TA, Yeo CJ, Cameron JL, et al. Resected adenocarcinoma of the pancreas-616 patients: results, outcomes, and prognostic indicators. J Gastrointest Surg 2000 Nov-Dec; 4 (6): 567-579. |
| 34. | Yeo CJ, Cameron JL, Sohn TA, et al. Six hundred fifty consecutive pancreaticoduodencetomies in the 1990s: pathology, complications, and outcomes. Ann Surg 1997 Sep; 226 (3): 248-257. |
| 35. | Foo ML, Gunderson LL, Nagorney DM, et al. Patterns of failure in grossly resected pancreatic ductal adenocarcinoma treated with adjuvant irradiation+/-5-fluorouracil. Int J Radiat Oncol Biol Phys 1993 Jun; 26 (3): 483-489. |
| 36. | Nukui Y, Picozzi VJ, Traverso LW. Interferon-based adjuvant chemoradiation therapy improves survival after pancreaticoduodenectomy for pancreatic adenocarcinoma. Am J Surg 2000 May; 179 (5): 367-371. |
| 37. | Poen JC, Collins HL, Niederhuber JE, et al. Chemo-radiotherapy for localized pancreatic cancer: increased dose intensity and reduced acute toxicity with concomitant radiotherapy and protracted venous infusion of 5-fluorouracil. Int J Radiat Oncol Biol Phys 1998 Jan; 40(1): 93-99. |
| 38. | Poen JC, Ford JM, Niederhuber JE. Chemoradiotherapy in the management of localized tumor of the pancreas. Ann Surg Oncol 1999 Jan-Feb; 6 (1): 117-122. |
| 39. | Evans DB, Rich TA, Byrd DR, et al. Preoperative chemoradiation and pancreaticoduodenectomy for adenocarcinoma of the pancreas. Arch Surg 1992 Nov; 127 (11): 1335-1339. |
| 40. | Staley CA, Lee JE, Cleary KK, et al. Preoperative chemoradiation, pancreaticoduodenectomy, and intraoperative radiation therapy for adenocarcinoma of the pancreatic head. Am J Surg 1996 Jan; 171 (1): 118-124. |
| 41. | Hoffman JP, Lipsitz S, Pisansky T, et al. Phase II trial of preoperative radiation therapy and chemotherapy for patients with localized resectable adenocarcinoma of the pancreas: an Eastern Cooperative Oncology Group Study. J Clin Oncol 1998 Jan; 16 (1): 317-323. |
| 42. | Pisters PW, Abbruzzese JL, Janjan NA, et al. Rapid-fractionation preoperative chemoradiation, pancreaticoduodenectomy, and intraoperative radiation therapy for resectable pancreatic adenocarcinoma. J Clin Oncol 1998 Dec; 16 (12): 3843-3850. |
| 43. | Breslin TM, Hess KR, Harbison DB, et al. Neoadjuvant chemoradiotherapy for adenocarcinoma of the pancreas : treatment variables and survival duration. Ann Surg Oncol 2001 Mar; 8 (2): 123-132. |
| 44. | Spitz FR, Abbruzzese JL, Lee JE, et al. Preoperative and postoperative chemoradiation strategies in patients treated with pancreaticoduodenectomy for adenocarcinoma of the pancreas. J Clin Oncol 1997 Mar; 15(3): 928-937. |
| 45. | Moertel CG, Frytaks, Hahn RG, et al. Therapy of locally unresectable pancreatic carcinoma: a randomized comparison of high dose (6000 rads) radiation alone, moderate dose radiation (4000 rads +5-fluorouracil), and high dose radiation + 5-fluorouracil: The Gastrointestinal Tumor Study Group. Cancer 1981 Oct; 48 (8): 1705-1710. |
| 46. | Klaassen DJ, MacIntyre JM, Catton GE, et al. Treatment of locally unresectable cancer of the stomach and pancreas : a randomized comparison of 5-fluorouracil alone with radiation plus concurrent and maintenance 5-fluorouracil- an Eastern Cooperative Oncology Group study. J Clin Oncol 1985 Mar; 3 (3): 373-378. |
| 47. | Whittington R, Neuberg D, Tester WJ, et al. Protracted intravenous fluorouracil infusion with radiation therapy management of localized pancreaticobiliary carcinoma: a phase I Eastern Cooperative Group Trial. J Clin Oncol 1995 Jan; 13 (1): 227-232. |
| 48. | Wagener D, Rougier P, wils J, et al. Combined chemoradiotherapy for locally advanced pancreatic cancer. Proc Am Soc Clin Oncol 1992; 11: 166. |
| 49. | Schein P, Smith F, Dritschillo A, et al. Phase I-II trial of combined modality FAM (5-fluorouracil, Adriamycin and mitomycin C) for locally advanced gastric and pancreatic cancer: a Mid-Atlantic Oncology Program Study. Proc Am Soc Clin Oncol 1983; 2: 126. |
| 50. | Wagener DJ, van Hoesel QG, Yap SH, et al. Phase II trial of 5-fluorouracil, Adriamycin and cisplatin (FAP) followed by radiation and 5-fluorouracil in locally advanced pancreatic ancer. Cancer Chemother Pharmacol 1989; 25(2): 131-134. |
| 51. | MCGinn CJ, Smith D, Szarka C, et al. A phase I study of gemcitabine in combination with radiation therapy in patients with localized, unresectable pancreatic cancer. Proc Am Soc Clin Oncol 1998; 17: 264a |
| 52. | Hoffman J, McGinn CJ, Szarka C, et al. A phase I study of preoperative gemcitabine with radiotion therapy followed by postoperative gemcitabine in patients with localized, resectable pancreatic adenocarcinoma. Proc Am Soc Clin Oncol 1998; 17: 283a. |
| 53. | McGinn CJ, Zalupshi MM. Radiation therapy with once-weekly in pancreatic cancer: current status of clinical trials. Int J Radiat Oncol Biol Phys 2003; 56 (4 Suppl ): 10-15. |
| 54. | Wolff RA, Evans DB, Gravel DM, et al. Phase I trial of gemcitabine combined with radiation for the treatment of locally advanced pancreatic adenocarcinoma. Clin Cancer Res 2001 Aug; 7 (8): 2246-2253. |
| 55. | Talamonti MS, Catalano PJ, Vaughn DJ, et al. Eastern Cooperatine Oncology Group phase I trial of protracted venous infusion fluorouracil plus weekly gemcitabine with concurrent radiation therapy in patients with locally advanced pancreas cancer: a regimen with unexpected early toxicity. J Clin Oncol 2000 Oct; 18(19): 3384-3389. |
| 56. | McGinn CJ, Zalupski MM, Shureiqui I, et al. A phase I trial of radiation dose escalation with concurrent weekly full-dose gemcitabine in patients with advanced pancreatic cancer. J Clin Oncol 2001 Nov; 19(22): 4202-4208. |
| 57. | Lawrence TS, Chang EY, Hahn TM, et al. Radiosensitization of pancreatic cancer cells by 2’;2’-difluoro-2’-deoxycytidine. Int J Radiat Oncol Biol Phys 1996 Mar; 34(4): 867-872. |
| 58. | Epelbaum R, Rosenblatt E, Nasrallah S, et al. Phase II study of gemcitabine combined with radiation therapy in localized, unresectable pancreatic cancer. Proc Am Soc Clin Oncol 2000; 19: 1029a. |
| 59. | Abad A, Arellano A, Burnet J, et al. Gemcitabine plus radiotherapy in stage II-III pancreatic cancer: a phase I trial. Proc 23rd Congress. Eur Soc Med Oncol 1998: 253a. |
| 60. | Kudrimoti M, Regine W, John W, et al. Concurrent gemcitabine and radiation in the treatment of advanced unresectable GI malignancy : a phase I/II study. Proc Am Soc Clin Oncol 1999; 18: 242a. |
| 61. | Higgins PD, Sohn JW, Fine RM, et al. Three-dimensional conformal pancreas treatment: comporison of four-to six-field techniques. Int J Radiat Oncol Biol Phys 1995 Feb; 31 (3): 605-609. |
| 62. | Ceha HM, van Tienhoven G, Gouma DJ, et al. Feasibility and efficacy of high dose conformal radiotherapy for patients with locally advanced pancreatic carcinoma. Cancer 2000 Dec; 89 (11): 2222-2229. |
| 63. | Horst E, Micke O, Moustakis C, et al. Conformal therapy for pancreatic cancer: variation of organ position due to gastrointestinal distention-implications for treatment planning. Radiology 2002 Mar; 222 (3): 681-686. |
| 64. | Busscls B, Goethals L, Feron M, et al. Respiration-induced movement of the upper abdominal organs: a pittfall for the three-dimensional conformal radiation treatment of pancreatic cancer. Radiother Oncol 2003 Jul: 68 (1): 69-74. |
| 65. | Ramsey CR, Scaperoth D, Arwood D, et al. Clinical efficacy of respiratory gated conformal radiation therapy. Med Dosim 1999 summer; 24(2): 115-119. |
| 66. | Syed AM, Puthawala AA, Neblett DL. Interstitial iodine125 implant in the management of unresectable pancreatic carcinoma. Cancer 1983 Sep; 52(5): 808-813. |
| 67. | Dobelbower RR Jr, Merrick HW 3rd , Ahuja RK, et al. 125I interstitial implant, precision high-dose external beam therapy, and 5FU for unresectable adenocarcinoma of pancreas and extrahepatic biliary tree. Cancer 1986 Nov; 58(10): 2185-2195 |
| 68. | Mohiuddin M, Cantor RJ, Biermann W, et al. Combined-modality treatment of localized unresectable adenocarcinoma of the pancreas. Int J Radiat Oncol Biol Phys 1988 Jan; 14(1): 79-84. |
| 69. | Abe M, Shibamoto Y, Ono K, et al. Intraoperative radiation therapy for carcinoma of the stomach and pancreas. Front Radiat Ther Oncol 1991; 25: 258-269 |
| 70. | Roldan GE, Gunderson LL, Nagorney DM, et al. External beam versus intraoperative and external beam irradiation for locally advanced pancreatic cancer. Cancer 1988 Mar; 61(6): 1110-1116. |
| 71. | Garton GR, Gunderson LL, Nagorney DM, et al. High-dose preoperative external beam and intraoperative irradiation for locally advanced pancreatic cancer. Int J Radiat Oncol Biol Phys 1993 Dec; 27(5): 1153-1157. |
| 72. | Tepper JE, Noyes DN, Krall JM, et al. Intraoperative radiation therapy of pancreatic carcinoma: a report of RTOG-8505. Radiation Therapy Oncology Group. Int J Radiat Oncol Biol Phys 1991 Oct; 21(5): 1145-1149. |







