บทบาทของรังสีรักษาในการรักษามะเร็งหลอดอาหาร
ชวลิต เลิศบุษยานุกูล พบ.
สาขารังสีรักษาและมะเร็งวิทยา
ภาควิชารังสีวิทยา คณะแพทยศาสตร์ จุฬาลงกรณ์มหาวิทยาลัย
บทนำ
การผ่าตัดยังคงเป็นการรักษาหลักในการดูแลผู้ป่วยมะเร็งหลอดอาหารบริเวณทรวงอก (thoracic esophagus) โดยมีมัธยฐานการ รอดชีวิตประมาณ 13 ถึง 15 เดือน(1) และมีอัตราการรอดชีวิตที่ 2 ปี ประมาณร้อยละ 34-37 (2,3) อย่างไรก็ตามมีผู้ป่วยเพียงร้อยละ 30-60 เท่านั้นที่มีก้อนมะเร็งอยู่ในระยะที่ผ่าตัดได้ ผู้ป่วยส่วนใหญ่มักจะอยู่ในระยะลุกลามเฉพาะที่ (locally advanced stage) ซึ่งจำเป็นต้อง ใช้การรักษาแบบผสมผสานด้วยการใช้รังสีเคมีบำบัด ซึ่งได้รับการพิสูจน์แล้วว่าได้ผลการรักษาดีกว่าการใช้รังสีรักษาเพียงอย่างเดียว (4)
รายงานการรักษาผู้ป่วยมะเร็งหลอดอาหารที่ได้รับรังสีเคมีบำบัดพบว่ามีมัธยฐานการรอดชีวิตประมาณ 11-22 เดือน (5-7) และมีอัตราการรอดชีวิตที่ 5 ป ีถึงร้อยละ 27 (8) เทียบเท่ากับผลการรักษาด้วยการผ่าตัด(9) ทำให้รังสีเคมีบำบัดเป็นทางเลือกที่ดี สำหรับผู้ป่วยที่เป็นมากหรือไม่แข็งแรงพอที่จะผ่าตัดได้
การรักษามะเร็งหลอดอาหารด้วยรังสีเคมีบำบัด
งานวิจัยที่สำคัญซึ่งกล่าวถึงการใช้รังสีเคมีบำบัดในการรักษามะเร็งหลอดอาหารคือรายงานRTOG85-01 ซึ่งเปรียบเทียบการใช้ รังสีรักษา 50 เกรย์ใน 5 สัปดาห์ร่วมกับยาเคมีบำบัด cisplatin (75mg/m2 วันแรก) และ FU (1,000 mg/m2/d continuous infusion 4วัน) ในสัปดาห์แรกและสัปดาห์สุดท้ายของการฉายรังสี เปรียบเทียบกับการใช้รังสีรักษาอย่างเดียว 64 เกรย์ใน 6.5 สัปดาห์พบว่าการรักษา แบบผสมผสานมีอัตราการรอดชีวิตที่ 3 ปี และ 5 ปีเท่ากับร้อยละ 30 และ 50 ตามลำดับซึ่งดีกว่าการใช้รังสีรักษาเพียงอย่างเดียวที่ร้อยละ 0 อย่างมีนัยสำคัญ(4) และรายงานล่าสุดหลังจากติดตามผู้ป่วยได้ 8 ปี พบว่ามีอัตราการรอดชีวิตในผู้ป่วยที่ได้รับรังสีเคมีบำบัดถึงร้อยละ 22 (10).
รายงานที่สองคือรายงาน EST 1282 ซึ่งสนับสนุนการใช้รังสีเคมีบำบัดโดยฉายรังสี 60 เกรย์ ร่วมกับการใช้ยาเคมี mitomycin และ 5-FU ว่าดีกว่าการฉายรังสีอย่างเดียว 60 เกรย์ใน 30 ครั้ง (11) โดยพบว่าสามารถเพิ่มอัตราการรอดชีวิตที่ 2 และ 5 ปี จากร้อยละ 12 และ 7 เป็นร้อยละ 27และ 9 ตามลำดับ ผู้ป่วยที่ได้รับรังสีเคมีบำบัดมีมัธยฐานเวลาการรอดชีวิต 14.8 เดือนเปรียบเทียบกับ 9.2 เดือนในผู้ที่ได้รับ รังสีรักษาเพียงอย่างเดียว
รายงาน RTOG 94-05 (12) เป็นความพยายามในการเพิ่มปริมาณรังสีจาก 50.4 เกรย์เป็น 64.8 เกรย์ร่วมกับการใช้ยาเคมี 5-FU และ cisplatin เหมือนในรายงาน RTOG 85-01 พบว่าผู้ป่วยที่ได้รับรังสีปริมาณสูงไม่ได้มีมัธยฐานการรอดชีวิต (13.0 vs 18.1 เดือน) อัตราการ รอดชีวิตที่ 2 ปี(31% vs 40%)และอัตราการกำเริบเฉพาะที่(56% vs 52%) เหนือกว่าการใช้รังสีเพียง 50.4 เกรย์ ทำให้ปัจจุบันแพทย์รังสีรักษา ยังคงใช้ปริมาณรังสี 50.4 เกรย์ใน 5.5 สัปดาห์เป็นมาตรฐานในการรักษา
การรักษามะเร็งหลอดอาหารด้วยการรักษาแบบผสมผสาน
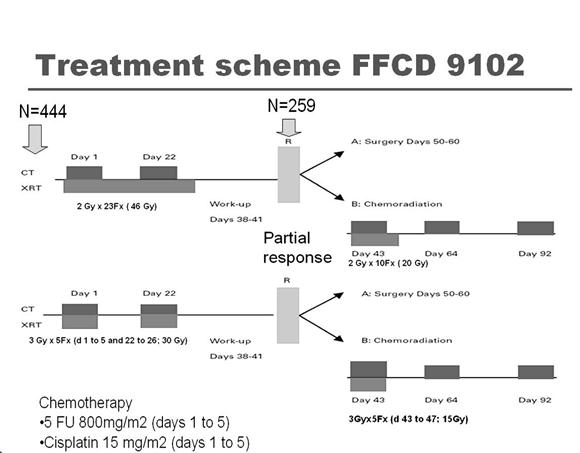
นอกจากความพยายามเพิ่มปริมาณรังสีแล้วยังมีความพยายามในการใช้รังสีเคมีบำบัดตามด้วยการผ่าตัดหลอดอาหาร เพื่อเพิ่มอัตรา การควบคุมโรคเฉพาะที่ดังรายงาน FFCD 9102 ซึ่งศึกษาผู้ป่วยมะเร็งหลอดอาหารในทรวงอกระยะ T3N0-1M0 โดยการใช้รังสีเคมีบำบัด เปรียบเทียบกับรังสีเคมีบำบัดตามด้วยการผ่าตัด (13) โดยใช้รังสีเคมีบำบัดนำ 2 รอบด้วยยา fluorouracil (FU) และ cisplatin ร่วมกับการ ฉายรังสีซึ่งมีทั้งการฉายรังสีแบบปกติ (46 เกรย์ใน 4.5 สัปดาห์) หรือการฉายรังสีแบบ split-course (15 เกรย์, ในวันที่ 1-5 และ 22-26) และเนื่องจากเหตุผลทางจริยธรรมผู้ป่วยที่มีการตอบสนองต่อการรักษานำเท่านั้นจึงจะได้รับการสุ่มเปรียบเทียบระหว่างกลุ่มแรก (กลุ่ม A) ให้การผ่าตัดตาม และ กลุ่ม B ให้รังสีเคมีบำบัดต่อ โดยใช้ยา cisplatin/5 FU ร่วมกับปริมาณรังสีเพิ่มอีก 20 เกรย์ในการฉายรังสีแบบปกติ และ เพิ่มอีก 15 เกรย์ในการรักษาแบบ split-course ผู้ป่วยที่ไม่มีการตอบสนองต่อการรักษานำจะได้รับการผ่าตัดโดยทันที (ดูภาพประกอบ 1) ผลการศึกษาพบว่าในจำนวนผู้ป่วย 444 รายที่เข้าร่วมการศึกษา มีผู้ป่วยเพียง 259 รายเท่านั้นที่มีการตอบสนองต่อการให้รังสีเคมีบำบัดนำ และได้รับการสุ่มดังกล่าวข้างต้น อัตราการรอดชีวิตที่ 2 ปีเท่ากับร้อยละ 34 ในกลุ่มAและร้อยละ 40 ในกลุ่มB ( P=0.44) มัธยฐานเวลา การรอดชีวิตเท่ากับ 17.7 และ 19.3 เดือนตามลำดับ สำหรับผู้ป่วยที่ไม่ตอบสนองต่อรังสีเคมีบำบัดนำตั้งแต่ตอนแรก (ซึ่งไม่ได้รับการสุ่ม) พบว่ามัธยฐานการรอดชีวิตแย่กว่าคือ 11.4 เดือน อัตราการควบคุมโรคเฉพาะที่ที่ 2 ปีเท่ากับร้อยละ 66.4 และ 57 ในกลุ่ม A และ B ตามลำดับ ผู้วิจัยสรุปว่าในผู้ป่วยมะเร็งหลอดอาหารระยะลุกลามเฉพาะที่เมื่อมีการตอบสนองต่อการใช้รังสีเคมีบำบัดนำโดยเฉพาะอย่างยิ่งในเซลล์ชนิด squamous cell carcinoma ไม่จำเป็นต้องได้รับการผ่าตัดตามแต่ให้ใช้รังสีเคมีบำบัดเพิ่ม
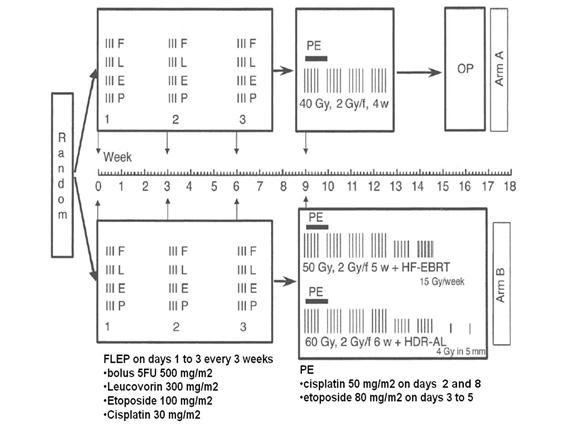
Stahl (14) รายงานผลการศึกษาในทิศทางเดียวกัน กล่าวคือศึกษาในผู้ป่วยมะเร็งหลอดอาหารชนิด squamous cell carcinoma จำนวน 172 รายโดยให้ยาเคมีบำบัดนำ 3 รอบด้วยยา fluorouracil, leucovorin, etoposide, and cisplatin ทุก 3 สัปดาห์ตามด้วยรังสีเคมีบำบัดโดยใช้ ปริมาณรังสี 40 เกรย์ แล้วสุ่มการรักษาระหว่างกลุ่ม A ตามด้วยการผ่าตัด และกลุ่ม B ตามด้วยรังสีเคมีบำบัดจนได้ปริมาณรังสีรวม 60 เกรย์ (ดูภาพประกอบ 2) พบว่าอัตราการรอดชีวิตที่ 2 ปีไม่แตกต่างกัน (39.9% ในกลุ่ม A vs 35.4% ในกลุ่ม B) เช่นเดียวกับไม่พบความแตกต่าง ของมัธยฐานเวลาการรอดชีวิต (16.4 เดือนในกลุ่ม A vs 14.9 เดือนในกลุ่ม B) แต่อัตราการควบคุมโรคที่ 2 ปี (2-year progression-free survival) ในกลุ่มที่ได้รับการผ่าตัดดีกว่ากลุ่มที่ได้รับรังสีเคมีบำบัดเสริม(64.3% vs 40.7%) เมื่อพิจารณาเฉพาะผู้ป่วยที่ตอบสนองต่อการให้ยาเคมีบำบัด นำพบว่ามีอัตราการรอดชีวิตที่ 3 ปีเหนือกว่ากลุ่มที่ไม่ตอบสนองต่อยาเคมีบำบัด
ภาพประกอบที่ 1 แสดงผังการศึกษาในงานวิจัย FFCD9102
ภาพประกอบที่ 2 แสดงผังการศึกษาในงานวิจัยของ Stahl
รายงาน 2 รายงานข้างต้นช่วยบอกว่าในผู้ป่วยที่ไม่ตอบสนองต่อการรักษานำอาจจำเป็นที่จะต้องทำการผ่าตัดเสริม ตารางที่ 1 สรุปผลการศึกษา 2 รายงานข้างต้น
ตารางที่ 1 สรุปงานวิจัยที่ศึกษาการให้รังสีเคมีบำบัดนำตามด้วยการผ่าตัด เปรียบเทียบกับการให้รังสีเคมีบำบัด
| FFCD 9102(13) | Stahl (14) | |
| Patients (n) A: CT/RT->Sx B: CT/RT |
Intent-to-treat: 259 129 130 |
Intent-to-treat: 172 86 86 |
|
Inclusion criteria |
Epidermoid (90%) Glandular (10%) Thoracic esophagus T3-4N0-1M0 Clinical eligibility for Sx or CT/RT |
SCC (100%)
Thoracic esophagus (upper or mid) T3-4N0-1M0 Good general condition + Lab |
|
Exclusion criteria |
Tracheobronchial involvement Visceral or SPC metas Weight loss > 15% Heart/Cirrhosis/Respiratory disease |
Tracheobronchial involvement |
|
Workup |
Gastroscope + Biopsy Esophagogram CT, EUS Bronchoscope SPC U/S |
Gastroscope + Biopsy Esophagogram CT, EUS |
|
Definition of Tumor response |
CR : No dysphagia/tumor in imaging PR : > 30% decrease in length on esophagogram |
CR : Same PR : > 50% tumor regression CT and > 50% reduction of intraesophageal tumor extension as assessed by barium swallow. |
|
Randomization |
After response to CT/RT |
At first |
| FFCD 9102 (13) | Stahl (14) | |
|
End point |
OS Hypothesis : Equivalence of 2yr OS |
OS Hypothesis : Equivalence of 2yr OS |
|
Chemotherapy |
Concurrent : Cis/5FU (q 3) x II-III |
Induction : 5FU/LV/Cis/Eto (q 3) x III 80% response, 20% Non response Concurrent : Cis/Eto x I |
|
Radiation |
Conventional RT A : 46Gy/23F -> Sx B : 46Gy/23F -> Boost to 66 Gy/33F Split-course RT A : 15Gy/5F q 3 wk x II (30Gy) -> Sx B : 15Gy/5F q 3 wk x III (45Gy) |
Conventional RT A : 40Gy/20F -> Sx B : 40Gy/20F -> Boost to 65+Gy/30F |
|
Surgery |
Transthoracic esophagectomy (94%) |
Transthoracic esophagectomy (100%) |
|
MST A B |
17.7 months 19.3 monsts |
16 months 15 months |
|
2Yr OS A B |
33.6% 39.8% |
39.9% 35.4% |
| Local control A B |
2Yrlocal control 66.4% 2Yrlocal control 57.0% |
2Yr PFS 64.3% 2Yr PFS 40.7% |
การศึกษาการให้รังสีเคมีบำบัดตามด้วยการผ่าตัดยังได้รับการเปรียบเทียบกับการผ่าตัดอย่างเดียวตามตารางที่ 2 (15-22) Bosset (15) รายงานผลการรักษาในผู้ป่วยมะเร็งหลอดอาหารชนิด squamous cell carcinoma เปรียบเทียบระหว่างการให้ยาเคมี cisplatin ร่วมกับการฉายรังสี 37 เกรย์ใน 10 ครั้งตามด้วยการผ่าตัด และการผ่าตัดอย่างเดียวพบว่าอัตราการรอดชีวิตไม่แตกต่างกัน ในทางกลับกัน Walsh (16) ศึกษาในผู้ป่วย มะเร็งหลอดอาหารชนิด adenocarcinoma พบว่าการให้เคมีบำบัดด้วย 5-FU, cisplatin ร่วมกับรังสีรักษา 40 เกรย์ ( ฉายครั้งละ 2.67 เกรย์) ตามด้วยการผ่าตัดดีกว่าการผ่าตัดเพียงอย่างเดียวโดยมีมัธยฐานเวลาการรอดชีวิตเท่ากับ 16 เดือนและ 11 ตามลำดับ
รายงาน CALGB 9781 ซึ่งเป็นการศึกษาโดยใช้ยาเคมี cisplatin (100mg/m2) และ 5FU (1000 mg/m2/d x 4 วัน) ในสัปดาห์แรก และสุดท้ายของการฉายรังสี (50.4 เกรย์ ใน 5.6 สัปดาห์) ตามด้วยการผ่าตัด เปรียบเทียบกับการผ่าตัดอย่างเดียวต้องปิดการวิจัยหลังจากได้ผู้ป่วย เพียง 56รายจากที่คาดไว้ 500 ราย โดยแบ่งเป็นผู้ป่วย 30 รายได้รับการรักษาแบบผสมผสาน และ 26 รายได้รับการผ่าตัดอย่างเดียว หลังจาก ติดตามผู้ป่วยเฉลี่ย 6 ปีพบว่ากลุ่มที่ได้รับการรักษาแบบผสมผสานมีอัตราการรอดชีวิตที่ 5 ปี (39% vs 16%) และ มัธยฐานเวลาการรอดชีวิต (4.5 ปี vs 1.8 ปี) ดีกว่ากลุ่มที่ได้รับการผ่าตัดอย่างเดียวอย่างมีนัยสำคัญ (17)
รายงานอื่นๆมีทั้งสนับสนุนและคัดค้านประโยชน์ของการรักษาแบบผสมผสานดังตารางที่ 2 อย่างไรก็ตามมีข้อสังเกตว่า การที่ การรักษาแบบผสมผสานอาจไม่ได้ผลดีกว่าการผ่าตัดอย่างเดียวอาจเป็นเพราะจำนวนผู้ป่วยในแต่ละงานวิจัยมีน้อยเกินไป การให้ปริมาณ รังสีแบบไม่มาตรฐาน หรือเทคนิคการฉายรังสีไม่ดีพอที่จะครอบคลุมก้อนมะเร็งทำให้มีผู้พยายามรวบรวมการวิจัยเป็นแบบ meta-analysis ดังแสดงในตารางที่ 3
Urschel (23) รวบรวมการศึกษา 9 รายงานโดยมีผู้ป่วยทั้งสิ้น 1,116 ราย เปรียบเทียบการผ่าตัดอย่างเดียวกับการให้รังสีเคมีบำบัดตามด้วยการผ่าตัดพบว่าการรักษาแบบผสมผสานสามารถเพิ่มอัตราการรอดชีวิตที่ 3 ปี และลดอัตราการกำเริบเฉพาะที่ การให้รังสีเคมีบำบัดนำทำให้มีอัตราcomplete pathological response ถึงร้อยละ21 และอัตราการรอดชีวิตสูงสุดพบในผู้ป่วยที่ได้รับการให้รังสีเคมีบำบัดพร้อมกัน (concurrent chemoradiation) มากกว่าการให้แบบเรียงกัน (sequential)
Fiorica (24) รวบรวมการศึกษา 6 รายงาน โดยมีผู้ป่วย 764 รายพบว่าการให้รังสีเคมีบำบัดนำสามารถลดขนาดของก้อนมะเร็ง ได้ดีมากและช่วยเพิ่มอัตราการรอดชีวิตที่ 3 ปีอย่างมีนัยสำคัญเมื่อเปรียบเทียบกับการผ่าตัดอย่างเดียวแม้ว่าอาจจะมีภาวะแทรกซ้อน หลังผ่าตัดสูงกว่า
Gebski (25) รวบรวมการศึกษา 10 รายงานมีผู้ป่วยทั้งสิ้น 1209 ราย พบว่าการรักษาแบบผสมผสานช่วยลดอัตราการตาย อย่างมีนัยสำคัญโดยมี hazard ratio เท่ากับ 0.81 (95% CI 0.70–0.93; p=0.002) เมื่อเปรียบเทียบกับการผ่าตัดอย่างเดียว และทำให้อัตรา การรอดชีวิตที่ 2 ปีสูงขึ้น13% (absolute difference in survival)
ตารางที่ 3 สรุป meta-analysis เปรียบเทียบระหว่างการรักษาแบบผสมผสานและการผ่าตัดอย่างเดียว
| Urschel(23) | Fiorica(24) | Gebski(25) | |
| (95%CI) | (95%CI) | (95%CI) | |
| Number of trials | 9 | 6 | 10 |
| Number of patients | 1116 | 764 | 1209 |
| OR of 3 Ys OS | 0.66 | 0.53 | 0.81 |
| 0.47-0.92 | 0.31-0.93 | 0.70-0.93 | |
| OR of resection | 2.5 | ||
| 1.05-5.96 | |||
| OR of downstaging | 0.43 | ||
| 0.26-0.72 | |||
| OR of complete resection | 0.53 | ||
| 0.33-0.84 | |||
| OR of operative mortality | 1.72 | 2.1 | |
| 0.96-3.07 | 1.18-3.73 | ||
| Subgroup analysis | |||
| 3Yr OS Concurrent chemoRT | 0.45 | 0.76* | |
| 0.26-0.79 | 0.59-0.98 | ||
| 3Yr OS Sequential chemoRT | 0.82 | 0.9* | |
| 0.54-1.25 | 0.72-1.03 | ||
| Mortality of adenocarcinoma | 0.24 | 0.75 | |
| 0.07-0.78 | 0.59-.095 | ||
| *only squamous cell CA was analyzed | |||
OR : odds ratio, neoadjuvant chemoradiation vs surgery alone (value <1 favor neoadjuvant chemoradiation)
ความก้าวหน้าทางรังสีรักษาและการฉายรังสีแบบปรับความเข้ม
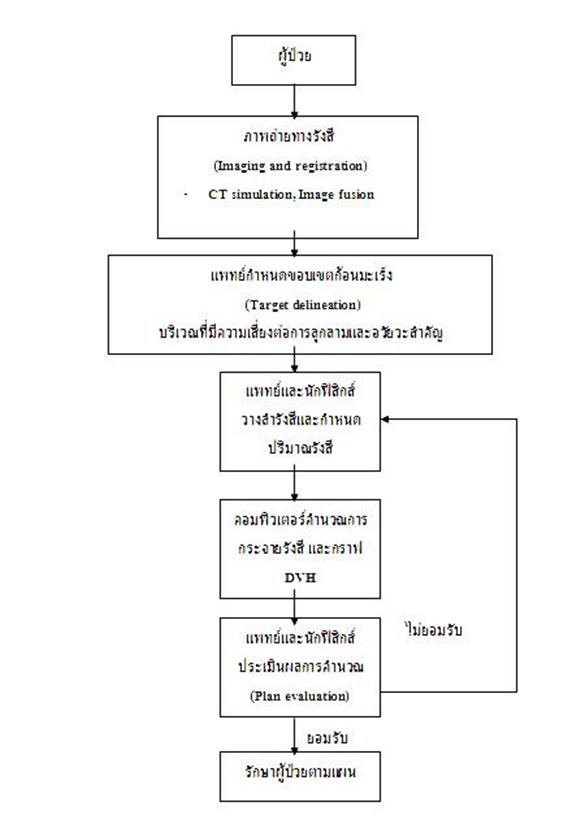
เดิมแพทย์รังสีรักษาได้ข้อมูลจากการทำ endoscope และการทำ barium swallow เท่านั้นและถึงแม้มีภาพเอ็กซเรย์คอมพิวเตอร์ ก็ไม่สามารถกำหนดทิศทางหรือปริมาณรังสีได้ ในระยะ 2 ทศวรรษที่ผ่านมาความก้าวหน้าทางคอมพิวเตอร์และภาพถ่ายทางการแพทย์ ไม่ว่าจะเป็นเอ็กซเรย์คอมพิวเตอร์ ภาพถ่ายคลื่นแม่เหล็กไฟฟ้า (MRI) หรือภาพถ่ายทางเวชศาสตร์นิวเคลียร์ (PET scan) มีส่วนช่วย ให้แพทย์สามารถวินิจฉัยก้อนมะเร็งและการลุกลามไปยังต่อมน้ำเหลืองได้แม่นยำขึ้น เทคโนโลยีเกี่ยวกับรังสีรักษาซึ่งสามารถเชื่อมโยง ภาพถ่ายทางรังสีไปยังเครื่องวางแผนการฉายรังสี (treatment planning machine) และเครื่องเร่งอนุภาค (linear accelerator) ตลอดจนการใช้วัตถุกำบังรังสี (multileaf collimator, MLC)เพื่อควบคุมพื้นที่และรูปร่างของลำรังสี (field aperture) มีส่วนช่วยให้เกิดการพัฒนาเทคนิคในการฉายรังสีบริเวณหลอดอาหารขึ้นมาก จากการฉายรังสีแบบ 2 มิติ (conventional radiation treatment, 2D RT) พัฒนาเป็นการฉายรังสีแบบ 3 มิติ (3 dimensional conformal radiation treatment, 3D CRT) และ การฉายรังสีแบบปรับความเข้ม (intensity modulated radiation treatment, IMRT) โดยแพทย์รังสีรักษาอาศัยภาพถ่ายทางรังสีในการกำหนดขอบเขตของก้อนมะเร็ง และต่อมน้ำเหลืองที่มีความเสี่ยงต่อการลุกลาม และกำหนดความเข้มและทิศทางของลำรังสี (beam configuration) คำนวณการกระจายของ ปริมาณรังสี (dose distribution calculation) และประเมินแผนการฉายรังสี (treatment plan evaluation) โดยอาศัยกราฟdose-volume-histogram (DVH) เพื่อช่วยบอกความครอบคลุมของรังสีต่อก้อนมะเร็งและอวัยวะปกติข้างเคียง หากประเมินแล้วได้แผนการรักษาที่เหมาะสมจึงจะเริ่ม ฉายรังสีให้กับผู้ป่วยจริง ดังกระบวนการตามภาพประกอบที่ 3
เนื่องจากกายวิภาคของอวัยวะบริเวณทรวงอกมีความซับซ้อน ก้อนมะเร็งบริเวณนี้ เช่น มะเร็งปอด มะเร็งหลอดอาหาร มักจะอยู่ใกล้ กับอวัยวะสำคัญ ได้แก่ ประสาทไขสันหลัง หัวใจ เนื้อปอดปกติ ซึ่งในการฉายรังสีแบบดั้งเดิม (conventional radiation therapy) และแบบ 3 มิติ ไม่สามารถเลี่ยงอวัยวะดังกล่าวได้ดี ทำให้อาจเกิดภาวะแทรกซ้อนระยะยาว เช่นปอดอักเสบหรือพังผืดจากการฉายรังสี ภาวะหลอดเลือด หัวใจตีบ หรือไม่สามารถให้ปริมาณรังสีสูงเพียงพอที่จะทำลายเซลล์มะเร็งทำให้เกิดการกำเริบเฉพาะที่ (local recurrent) การฉายรังสีแบบ ปรับความเข้มมีข้อได้เปรียบกว่าการฉายรังสีแบบ 3 มิติ กล่าวคือ การกระจายปริมาณรังสี ครอบคลุมและกระชับกับก้อนมะเร็ง (dose conformity) ดีขึ้น ทำให้สามารถป้องกันอวัยวะปกติข้างเคียงได้ นอกจากนี้ยังสามารถกำหนดความเข้มในจุดต่าง ๆ ของก้อนมะเร็ง ให้ได้รับปริมาณรังสีต่าง ๆ กัน ซึ่งเรียกว่า dose painting หรือ simultaneous integrated boost (SIB) เพื่อให้ปริมาณรังสีต่อก้อนมะเร็งได้สูงขึ้น (dose escalation) และทำลายก้อนมะเร็งได้ดีขึ้น อย่างไรก็ตามขั้นตอนในการฉายรังสีแบบปรับความเข้มมีความยุ่งยากและใช้ทรัพยากรมาก จึงควรเลือกใช้ในมะเร็งที่อยู่ใกล้อวัยวะสำคัญ หรือบริเวณที่เทคนิคการฉายรังสีแบบดั้งเดิมเป็นไปได้ยากเช่นมะเร็งหลอดอาหารส่วนต้น (cervical esophageal cancer) และมะเร็งหลอดอาหารบริเวณทรวงอกที่ต้องการเพิ่มปริมาณรังสีให้มากกว่า 50 เกรย์
ภาพประกอบที่ 3 แสดงกระบวนการวางแผนการรักษาด้วยการฉายรังสีแบบปรับความเข้ม
รายงานการฉายรังสีแบบปรับความเข้มในการรักษามะเร็งหลอดอาหารมีไม่มากนัก การศึกษาโดย Wu (26)ในผู้ป่วยมะเร็ง หลอดอาหารในทรวงอก 15 ราย โดยการเปรียบเทียบระหว่างการฉายรังสี 3 มิติและการฉายรังสีแบบปรับความเข้มโดยมีเป้าหมายให้ก้อน มะเร็งได้รับปริมาณรังสี 60 เกรย์ พบว่าการฉายรังสีแบบปรับความเข้มสามารถลดปริมาณรังสีต่อปอดและหัวใจได้ แต่ปริมาณรังสีต่อเส้นประสาทไขสันหลังไม่แตกต่างกัน
Nutting (27) เปรียบเทียบแผนการฉายรังสีด้วยการฉายรังสีแบบ 3 มิติ และแบบปรับความเข้มโดยเลือกมุมตกกระทบต่อผู้ป่วยต่างๆ กันในผู้ป่วย 5 ราย และมีเป้าหมายให้ปริมาณรังสี 55 เกรย์ รายงานผลการศึกษาเช่นเดียวกันว่าการฉายรังสีแบบปรับความเข้มสามารถ ลดปริมาณรังสีเฉลี่ยต่อปอดจาก 11 เกรย์เหลือ 9.5 เกรย์ โดยความครอบคลุมต่อก้อนมะเร็งและปริมาณรังสีต่อไขสันหลังไม่แตกต่างจากการฉายรังสีแบบ 3 มิติ
Zhang (28) ทำการศึกษาเปรียบเทียบระหว่างการฉายรังสีแบบปรับความเข้มโดยใช้ลำรังสี 5 ทิศทาง และการฉายรังสีโดยใช้โปรตอน พบว่าปริมาณรังสีต่อเส้นประสาทไขสันหลังลดลงจาก 41 เกรย์เหลือ 25.6 เกรย์เมื่อใช้โปรตอนลำรังสี 3 ทิศทาง นอกจากนั้นการใช้โปรตอน ยังสามารถลดปริมาณรังสีเฉลี่ยต่อปอดจาก 9.6 เกรย์เหลือ 4.5-6.6 เกรย์ และลดปริมาณรังสีต่อหัวใจได้อีกด้วย แต่น่าเสียดายที่รังสีโปรตอน ไม่มีใช้ในประเทศไทย เนื่องจากเครื่องมีราคาสูงมาก (มากกว่า 1000 ล้านบาท) และมีที่ใช้เฉพาะบางประเทศ เช่น ญี่ปุ่นและอเมริกา ซึ่งส่วนใหญ่ใช้ในงานวิจัยมากกว่างานบริการ
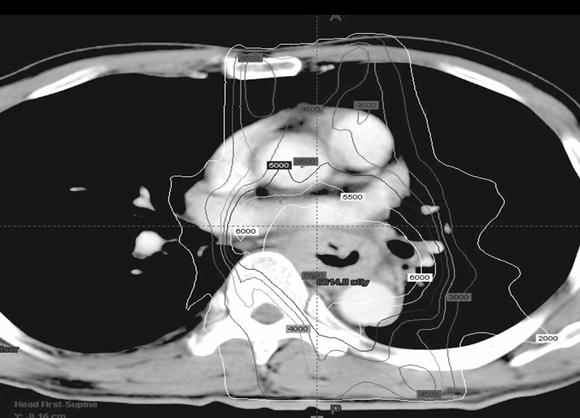
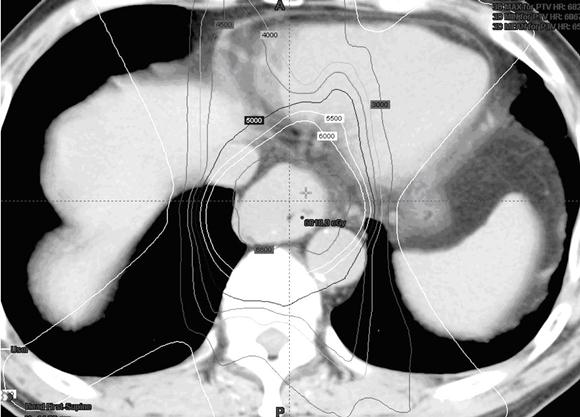
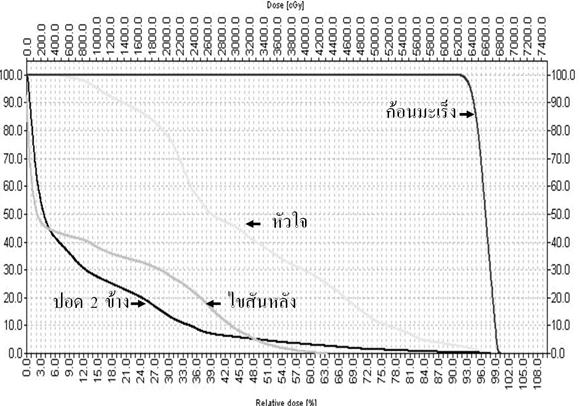
ในโรงพยาบาลจุฬาลงกรณ์ได้มีการใช้การรักษาแบบผสมผสาน กล่าวคือใช้การฉายรังสีแบบปรับความเข้มโดยเพิ่มปริมาณรังสี ต่อก้อนมะเร็งมากกว่า 60 เกรย์ ร่วมกับยาเคมีบำบัด cisplatin และ 5FU ตามด้วยการผ่าตัด ซึ่งยังคงต้องติดตามผลการรักษาในระยะยาวต่อไป ภาพประกอบที่ 4,5 และ 6 แสดงการกระจายปริมาณรังสีด้วยการฉายรังสีแบบปรับความเข้มและกราฟ dose-volume histogram ในผู้ป่วยมะเร็งหลอดอาหารที่ได้รับการรักษาในรพ.จุฬาลงกรณ์ เห็นได้ว่าเส้นแสดงปริมาณรังสี 60 เกรย์สามารถครอบคลุมก้อนมะเร็ง โดยปริมาณรังสีที่ปอดและเส้นประสาทไขสันหลังได้รับปริมาณรังสีปริมาณน้อยและไม่เกินขีดจำกัดของแต่ละอวัยวะ
ภาพประกอบที่ 4 แสดงการกระจายปริมาณรังสีในผู้ป่วยมะเร็งหลอดอาหาร
ภาพประกอบที่ 5 แสดงการกระจายปริมาณรังสีในผู้ป่วยมะเร็งหลอดอาหาร
ภาพประกอบที่ 6 แสดงกราฟ dose volume histogram ของการฉายรังสีแบบปรับความเข้ม สังเกตว่าปริมาตรที่ปอดได้รับปริมาณรังสี 20 เกรย์ เท่ากับร้อยละ 15 ซึ่งน้อยมาก ในขณะที่เส้นประสาทไขสันหลังได้รับปริมาณรังสีสูงสุด 43 เกรย์ และก้อนมะเร็งได้รับรังสีอย่างน้อย 63 เกรย์
สรุป
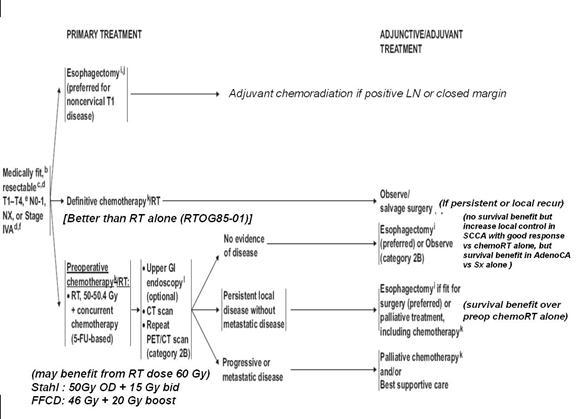
โดยสรุป การรักษาด้วยการผ่าตัดยังคงเป็นการรักษาหลักในผู้ป่วยมะเร็งหลอดอาหารระยะผ่าตัดได้ การให้รังสีเคมีบำบัดเสริม หลังผ่าตัดเป็นสิ่งจำเป็นในผู้ป่วยที่ผ่าตัดได้ขอบเขตไม่เพียงพอหรือมีการลุกลามต่อมน้ำเหลือง ผู้ป่วยที่อยู่ในระยะที่ผ่าตัดไม่ได้สามารถรักษา โดยการให้รังสีเคมีบำบัดเป็นการรักษาหลัก ซึ่งหากผลการตอบสนองต่อรังสีเคมีบำบัดไม่ดีต้องตามด้วยการผ่าตัดซึ่งมีประโยชน์ในการช่วย เพิ่มอัตรารอดชีวิต และอัตราการควบคุมโรคเฉพาะที่ แต่ในรายที่ก้อนมะเร็งตอบสนองดีต่อรังสีเคมีบำบัด อาจให้การผ่าตัดตามเพื่อเพิ่มอัตรา การควบคุมโรคเฉพาะที่ ดังสรุปในภาพประกอบที่ 7 ความก้าวหน้าทางรังสีรักษามีส่วนช่วยให้สามารถเพิ่มปริมาณรังสีต่อก้อนมะเร็งและ ลดอัตราการเกิดภาวะแทรกซ้อนได้ซึ่งการฉายรังสีแบบปรับความเข้มเป็นอีกวิธีหนึ่งในความก้าวหน้าดังกล่าว การติดตามผลการรักษา ด้วยการฉายรังสีแบบปรับความเข้มเป็นสิ่งที่ต้องติดตามในอนาคต
ภาพประกอบที่ 7 สรุปแนวทางการรักษามะเร็งหลอดอาหารดัดแปลงจาก NCCN guideline
อ้างอิง
1. Wu PC, Posner MC. The role of surgery in the management of oesophageal cancer. Lancet Oncol. 2003;4:481-8.
2. Fok M, Sham JS, Choy D, Cheng SW, Wong J. Postoperative radiotherapy for carcinoma of the esophagus: a prospective, randomized controlled study. Surgery. 1993 ;113:138-47
3. Medical Research Council Oesophageal Cancer Working Group. Surgical resection with or without preoperative chemotherapy in oesophageal cancer: a randomised controlled trial. Lancet. 2002;359:1727-33.
4. Herskovic A, Martz K, al-Sarraf M, Leichman L, Brindle J, Vaitkevicius V, et al. Combined chemotherapy and radiotherapy compared with radiotherapy alone in patients with cancer of the esophagus. N Engl J Med. 1992;326:1593-8.
5. Coia LR, Engstrom PF, Paul AR, Stafford PM, Hanks GE. Long-term results of infusional 5-FU, mitomycin-C and radiation as primary management of esophageal carcinoma. Int J Radiat Oncol Biol Phys. 1991;20:29-36.
6. Leichman L, Herskovic A, Leichman CG, Lattin PB, Steiger Z, Tapazoglou E, et al. Nonoperative therapy for squamous-cell cancer of the esophagus. J Clin Oncol. 1987;5:365-70.
7. Seitz JF, Giovannini M, Padaut-Cesana J, Fuentes P, Giudicelli R, Gauthier AP, et al. Inoperable nonmetastatic squamous cell carcinoma of the esophagus managed by concomitant chemotherapy (5-fluorouracil and cisplatin) and radiation therapy. Cancer. 1990;66:214-9.
8. al-Sarraf M, Martz K, Herskovic A, Leichman L, Brindle JS, Vaitkevicius VK, et al. Progress report of combined chemoradiotherapy versus radiotherapy alone in patients with esophageal cancer: an intergroup study. J Clin Oncol. 1997;15:277-84.
9. Kelsen DP, Ginsberg R, Pajak TF, Sheahan DG, Gunderson L, Mortimer J, et al. Chemotherapy followed by surgery compared with surgery alone for localized esophageal cancer. N Engl J Med. 1998 ;339:1979-84.
10. Cooper JS, Guo MD, Herskovic A, Macdonald JS, Martenson JA Jr, Al-Sarraf M, et al. Chemoradiotherapy of locally advanced esophageal cancer: long-term follow-up of a prospective randomized trial (RTOG 85-01). Radiation Therapy Oncology Group. JAMA.1999;281:1623-7.
11. Smith TJ, Ryan LM, Douglass HO Jr, Haller DG, Dayal Y, Kirkwood J, et al. Combined chemoradiotherapy vs. radiotherapy alone for early stage squamous cell carcinoma of the esophagus: a study of the Eastern Cooperative Oncology Group. Int J Radiat Oncol Biol Phys.1998;42:269-76.
12. Minsky BD, Pajak TF, Ginsberg RJ, Pisansky TM, Martenson J, Komaki R, et al. INT 0123 (Radiation Therapy Oncology Group 94-05) phase III trial of combined-modality therapy for esophageal cancer: high-dose versus standard-dose radiation therapy. J Clin Oncol.2002;20:1167-74.
13. Bedenne L, Michel P, Bouché O, Milan C, Mariette C, Conroy T, et al. Chemoradiation followed by surgery compared with chemoradiation alone in squamous cancer of the esophagus: FFCD 9102. J Clin Oncol. 2007;25:1160-8.
14. Stahl M, Stuschke M, Lehmann N, Meyer HJ, Walz MK, Seeber S, et al. Chemoradiation with and without surgery in patients with locally advanced squamous cell carcinoma of the esophagus. J Clin Oncol. 2005;23:2310-7.
15. Bosset JF, Gignoux M, Triboulet JP, Tiret E, Mantion G, Elias D, et al. Chemoradiotherapy followed by surgery compared with surgery alone in squamous-cell cancer of the esophagus. N Engl J Med. 1997;337:161-7.
16. Walsh TN, Noonan N, Hollywood D, Kelly A, Keeling N, Hennessy TP. A comparison of multimodal therapy and surgery for esophageal adenocarcinoma. N Engl J Med. 1996;335:462-7.
17. Krasna M, Tepper JE, Niedzwiecki D, Hollis D, Reed C, Goldberg RM, et al. Trimodality therapy is superior to surgery alone in esophageal cancer: Results of CALGB 9781. J Clin Oncol 2006; 24(18S): abstract # 4
18. Burmeister BH, Smithers BM, Gebski V, Fitzgerald L, Simes RJ, Devitt P, et al. Surgery alone versus chemoradiotherapy followed by surgery for resectable cancer of the oesophagus: a randomised controlled phase III trial. Lancet Oncol. 2005;6:659-68.
19. Urba SG, Orringer MB, Turrisi A, Iannettoni M, Forastiere A, Strawderman M. Randomized trial of preoperative chemoradiation versus surgery alone in patients with locoregional esophageal carcinoma. J Clin Oncol. 2001;19:305-13.
20. Le Prise E, Etienne PL, Meunier B, Maddern G, Ben Hassel M, Gedouin D, et al. A randomized study of chemotherapy, radiation therapy, and surgery versus surgery for localized squamous cell carcinoma of the esophagus. Cancer. 1994;73:1779-84.
21. Nygaard K, Hagen S, Hansen HS, Hatlevoll R, Hultborn R, Jakobsen A, et al. Pre-operative radiotherapy prolongs survival in operable esophageal carcinoma: a randomized, multicenter study of pre-operative radiotherapy and chemotherapy. The second Scandinavian trial in esophageal cancer. World J Surg. 1992;16:1104-9
22. Apinop C, Puttisak P, Preecha N. A prospective study of combined therapy in esophageal cancer. Hepatogastroenterology. 1994;41:391-3.
23. Urschel JD, Vasan H. A meta-analysis of randomized controlled trials that compared neoadjuvant chemoradiation and surgery to surgery alone for resectable esophageal cancer. Am J Surg. 2003;185:538-43.
24. Fiorica F, Di Bona D, Schepis F, Licata A, Shahied L, Venturi A, et al. Preoperative chemoradiotherapy for oesophageal cancer: a systematic review and meta-analysis. Gut. 2004;53:925-30.
25. Gebski V, Burmeister B, Smithers BM, Foo K, Zalcberg J, Simes J, et al. Survival benefits from neoadjuvant chemoradiotherapy or chemotherapy in oesophageal carcinoma: a meta-analysis. Lancet Oncol. 2007;8:226-34.
26. Wu VW, Sham JS, Kwong DL. Inverse planning in three-dimensional conformal and intensity-modulated radiotherapy of mid-thoracic oesophageal cancer. Br J Radiol. 2004;77:568-72.
27. Nutting CM, Bedford JL, Cosgrove VP, Tait DM, Dearnaley DP, Webb S. A comparison of conformal and intensity-modulated techniques for oesophageal radiotherapy. Radiother Oncol. 2001;61:157-63
28. Zhang X, Zhao K, Guerrero TM, Mcguire SE, Yaremko B, Komaki R, et al. Four-dimensional computed tomography-based treatment planning for intensity-modulated radiation therapy and proton therapy for distal esophageal cancer. Int J Radiat Oncol Biol Phys. 2008;72:278-87